题目内容
下列说法正确的是( )
A 活化分子的每一次碰撞都能够发生化学反应
B 反应物用量增加后,有效碰撞次数增多,反应速率增大
C 能够发生有效碰撞的分子叫做活化分子
D 加入催化剂对化学反应速率无影响
A 活化分子的每一次碰撞都能够发生化学反应
B 反应物用量增加后,有效碰撞次数增多,反应速率增大
C 能够发生有效碰撞的分子叫做活化分子
D 加入催化剂对化学反应速率无影响
C
A 并不是活化分子的每一次碰撞都能够发生化学反应,只有方向合适才会发生有效碰撞,A错;
B 固体或纯液体用量的增加不会影响反应速率;B错;
C 能够发生有效碰撞的分子叫做活化分子,正确;
D 加入催化剂会加快化学反应速率,D错
选C.
B 固体或纯液体用量的增加不会影响反应速率;B错;
C 能够发生有效碰撞的分子叫做活化分子,正确;
D 加入催化剂会加快化学反应速率,D错
选C.

练习册系列答案
相关题目

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是

 2CO(g),K1
2CO(g),K1 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下: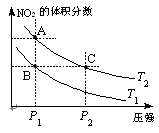
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)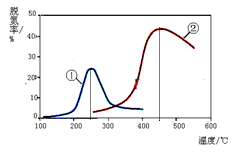
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。 B(g)+2C(g),增大压强反应速率加快,A的转化率减小
B(g)+2C(g),增大压强反应速率加快,A的转化率减小