题目内容
【题目】已知可逆反应aA2 +bB2![]() xX(反应物、生成物都是气体)。回答下列问题:
xX(反应物、生成物都是气体)。回答下列问题:
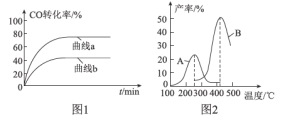
I.将一定量的两种反应物置于恒容绝热反应器中(与外部环境无热量交换的反应器),反应器内的温度与时间的关系如图:

(1)该反应是___ (填“吸”或“ 放”)热反应。
(2)下列关于该反应的叙述正确的是____ (填字母)。
a A点反应停止 b A点速率不为零
c 反应物的总能量大于生成物的 d B点正反应速率大于逆反应速率
II.将一定量的上述反应的反应物与生成物置于容积为2L的恒温恒容反应器中,反应器中各物质的物质的量与时间的关系如图:

(3)①反应前4 min物质x的物质的量的变化为_____mol. .
②反应前4 min物质A2反应速率为_______
③该可逆反应的化学方程式为______(物质X用A、B表示)。
④如果在4 min时升高反应体系的温度.则反应速率___ ( 填“增大“减小”或“不变")。
⑤如果在4min时加入2.4 mol Ne(Ne不参与该反应),则反应速率___ (填“增大”“减小”或“不变”)。
【答案】吸 b d 0.4 0.025mol·L-1·min-1 A2+3B2 ![]() 2AB3 增大 不变
2AB3 增大 不变
【解析】
I.(1)由图可知,随着反应不断进行,温度逐渐下降,说明该反应为吸热反应,故本题答案为:吸;
(2)a.由图可知,A点是平衡状态,是动态平衡,反应未停止,a错误;
b.由图可知,A点是平衡状态,是动态平衡,反应仍在进行,A点速率不为零,b正确;
c.该反应为吸热反应,反应物的总能量小于生成物的总能量,c错误;
d.B点未达到平衡状态,反应在正向进行,所以正反应速率大于逆反应速率,d正确;
故本题答案为:bd ;
II.(3)①由图可知,反应前4 min物质x的物质的量的变化为0.8mol-0.4mol=0.4mol,故本题答案为:0.4;
②反应前4 min物质A2的变化量为0.2mol,反应速率为![]() =0.025mol·L-1·min-1,故本题答案为:0.025mol·L-1·min-1;
=0.025mol·L-1·min-1,故本题答案为:0.025mol·L-1·min-1;
③在0-4min时,A2的化学反应反应速率为![]() =0.025mol·L-1·min-1,B2的化学反应反应速率为
=0.025mol·L-1·min-1,B2的化学反应反应速率为![]() =0.075mol·L-1·min-1,X的化学反应反应速率为
=0.075mol·L-1·min-1,X的化学反应反应速率为![]() =0.05mol·L-1·min-1,化学反应速率之比等于化学计量数之比,即化学计量数之比为:A2:B2:X=1:3:2,根据原子守恒,则该可逆反应的化学方程式为A2+3B2
=0.05mol·L-1·min-1,化学反应速率之比等于化学计量数之比,即化学计量数之比为:A2:B2:X=1:3:2,根据原子守恒,则该可逆反应的化学方程式为A2+3B2![]() 2AB3,故本题答案为:A2+3B2
2AB3,故本题答案为:A2+3B2![]() 2AB3;
2AB3;
④升高反应体系的温度,活化分子数增多,反应速率增大,故本题答案为:增大;
⑤在4min时加入2.4 mol Ne,Ne不参与该反应,由于是恒容体系,对反应物浓度无影响,对反应速率也无影响,所以反应速率不变,故本题答案为:不变。

【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
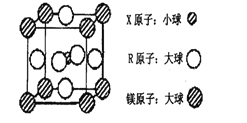
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
【题目】有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大
②E元素的电离能数据见下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
③B与F分别同主族
④A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物
⑤B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、______________
(2)B2A2分子中存在____个σ键,____个π键
(3)E2D2电子式____________