题目内容
【题目】溴酸镉[Cd(BrO3)2]常用于生产颜料和荧光粉。以镉铁矿(成分为CdO2、Fe2O3、FeO及少量的Al2O3和SiO2)为原料制备[Cd(BrO3)2]的流程如下:
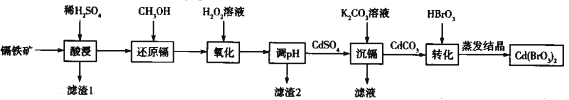
已知:Cd(SO4)2溶于水。
(1)Cd(BrO3)2中Cd的化合价为__________
(2)酸浸时,为了提高镉的浸取率可以采取的指施有__________(写出两种即可)。
(3)还原镉时,产生能使澄清石灰水变浑浊的气体,其发生反应的离于方程式为__________
(4)用H2O2溶液氧化时,氧化剂与还原剂的物质的量之比为__________
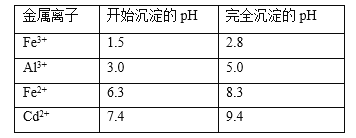
(5)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,调pH时,应调整的pH范为____,滤渣2的主要成分为_____(填化学式)。
(6)实际工业生产中,有时还采用阳离子交换树脂法来测定沉镉后溶液中Cd2+的含量,其原理是: Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将沉镉后的溶液(此时溶液pH=6)经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.046g/L,则该条件下Cd(OH)2的Ksp值为____
(7)已知镉铁矿中CdO2的含量为72%,整个流程中镉元素的损耗率为8%,则2t该镉铁矿可制得Cd(BrO3)2(相对分子质量为368)_____Kg。
【答案】+2 将矿石粉碎、适当升高浸取时的温度、延长浸取的时间、增大浸取液的浓度、充分搅拌等 3Cd4++CH3OH+H2O=3Cd2++CO2↑+6H+ 1:2 5. 0≤pH<7.4 Fe(OH)3和Al(OH)3 10-19 3385.6
【解析】
用稀硫酸溶解镉铁矿(成分为CdO2、Fe2O3、FeO及少量的Al2O3和SiO2),其中SiO2不溶于水和酸,通过过滤除去,即滤渣1为SiO2;滤液中主要含有Fe2+、Fe3+、Al3+及Cd4+,加入CH3OH将Cd4+还原为Cd2+,然后加入H2O2溶液,将溶液中的Fe2+氧化为Fe3+,再调节溶液pH使溶液中的Al3+、Fe3+完全转化为Al(OH)3、Fe(OH)3沉淀,过滤除去不溶物,向含有CdSO4的滤液中加入K2CO3生成CdCO3沉淀,再过滤将沉淀溶于HBrO3,最后将溶液蒸发结晶即可得到溴酸镉[Cd(BrO3)2],据此分析解答(1)~(5)。
(6)将沉镉后的溶液pH=6,则c(OH-)=1×10-8mol/L,经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.046g/L,即Na+浓度增加了 =0.002mol/L,根据Cd2++2NaR=2Na++CdR2,可知原溶液中c(Cd2+)=0.001mol/L,再计算Cd(OH)2的Ksp;
=0.002mol/L,根据Cd2++2NaR=2Na++CdR2,可知原溶液中c(Cd2+)=0.001mol/L,再计算Cd(OH)2的Ksp;
(7) 2t该镉铁矿中CdO2的质量为2×106g×72%=1.44×106g,其物质的量为![]() =0.01×106mol,再根据整个流程中镉元素的损耗率为8%,并结合原子守恒计算Cd(BrO3)2的质量。
=0.01×106mol,再根据整个流程中镉元素的损耗率为8%,并结合原子守恒计算Cd(BrO3)2的质量。
(1)在Cd(BrO3)2中Br元素为+5价,O元素为-2价,根据正负化合价代数和为0,可知Cd的化合价为+2;
(2)固体溶解于稀硫酸时,采取增大稀硫酸的浓度、将固体粉碎、用玻璃棒搅拌或适当加热等措施,可提高镉的浸取率;
(3) CH3OH将Cd4+还原为Cd2+时,产生能使澄清石灰水变浑浊的气体,此气体为CO2,结合守恒法,可知发生反应的离于方程式为3Cd4++CH3OH+H2O=3Cd2++CO2↑+6H+;
(4)用H2O2溶液将溶液中的Fe2+氧化为Fe3+时,发生反应的离子方程式为2Fe2++ H2O2+2H+= 2Fe3++H2O,则氧化剂H2O2与还原剂Fe2+的物质的量之比为1:2;
(5) Fe3+完全转化为Fe(OH)3沉淀时的pH为2.8,Al3 +完全转化为Al(OH)3沉淀时的pH为5.0,Cd2+开始转化为Cd(OH)2沉淀时的pH为7.4,则调节溶液的pH范围为5. 0≤pH<7.4,此时获得Al(OH)3、Fe(OH)3沉淀,即过滤的滤渣2为Al(OH)3、Fe(OH)3;
(6)将沉镉后的溶液pH=6,则c(OH-)=1×10-8mol/L,经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.046g/L,即Na+浓度增加了 =0.002mol/L,根据Cd2++2NaR=2Na++CdR2,可知原溶液中c(Cd2+)=0.001mol/L,则Cd(OH)2的Ksp= c(Cd2+)×c2 (OH-)=1×10-19;
=0.002mol/L,根据Cd2++2NaR=2Na++CdR2,可知原溶液中c(Cd2+)=0.001mol/L,则Cd(OH)2的Ksp= c(Cd2+)×c2 (OH-)=1×10-19;
(7) 2t该镉铁矿中CdO2的质量为2×106g×72%=1.44×106g,其物质的量为![]() =0.01×106mol,整个流程中镉元素的损耗率为8%,根据原子守恒可知获得Cd(BrO3)2的物质的量为0.01×106mol×(1-8%)=9.2×103mol,其质量为9.2×103mol×368g/mol=3.3856×106g=3385.6Kg。
=0.01×106mol,整个流程中镉元素的损耗率为8%,根据原子守恒可知获得Cd(BrO3)2的物质的量为0.01×106mol×(1-8%)=9.2×103mol,其质量为9.2×103mol×368g/mol=3.3856×106g=3385.6Kg。

【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%