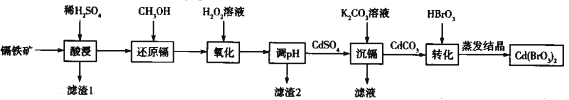
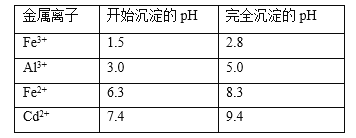
题目内容
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。下列说法不正确的是( )

A. 原料X与中间体Y互为同分异构体
B. 原料X可以使酸性KMnO4溶液褪色
C. 中间体Y能发生还原、加成、取代、氧化、水解反应
D. 1 mol依曲替酯只能与1 mol NaOH发生反应
【答案】D
【解析】
A. 原料X与中间体Y的分子式都是C13H12O4,结构不同,所以互为同分异构体,故A正确;
B. 原料X含有碳碳双键、苯环上含有甲基,所以可以使酸性KMnO4溶液褪色,故B正确;
C. 中间体Y含有羰基、碳碳双键能与氢气发生加成反应,中间体Y含有酯基、酚羟基能发生取代反应,中间体Y含有酚羟基能发生氧化反应、中间体Y含有酯基能发生水解反应,故C正确
D. 1 mol依曲替酯含有1mol酚羟基形成的酯基,能与2mol NaOH发生反应,故D错误,选D。

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】为检验溶液中是否含有Cl-,某同学采用向溶液中先加HNO3,再加AgNO3,溶液的实验方案,若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | ||
① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
(1)实验一中产生沉淀的离子方程式为______。
(2)学生设计了如下表格,对实验一内容进行理论计算,请帮他完成表格。(表中不要留空格)。
[25℃时Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10]
编号 | AgNO3浓度/(mol·L-1) | 稀释后Ag+浓度/(mol·L-1) | 混合液中SO42-的最小理论检出浓度/(mol·L-1) |
① | 2 | 0.2 | 0.0003 |
② | 0.5 | _______ | 0.0048 |
③ | 0.1 | 0.0l | 0.12 |
④ | _______ | 0.001 | _________ |
若向lmL某溶液中加入3滴0.1mol/LAgNO3溶液,分析上面数据,判断下列说法正确的是__ (填字母序号)。
A.混合液中c(SO42-)=0.1mol/L时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1mol/L时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol/LAgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)将实验一中编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
编号 | AgNO3溶液 浓度/(mol·L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设一。(已知:H2SO4=H++HSO4-、HSO4-![]() H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
假设一:_____________。
假设二:NO3-对Ag2SO4溶解起作用。
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立。请写出实验步骤和结论。(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体)
________________
(5)通过(4)的实验,若证实假设一成立,请用平衡理论解释Ag2SO4溶解的原因_________