题目内容
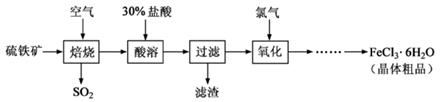
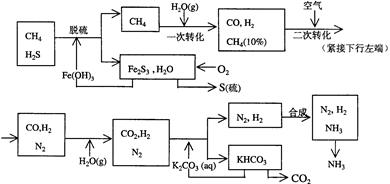
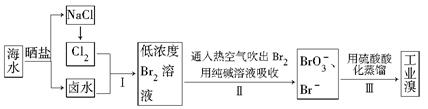
(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)
 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 (2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
(12分)(1)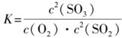 SO2+NaOH=NaHSO3
SO2+NaOH=NaHSO3
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl—+2Fe3+ Cl2、HCl
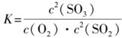 SO2+NaOH=NaHSO3
SO2+NaOH=NaHSO3(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl—+2Fe3+ Cl2、HCl
】(1)平衡常数是指在一定条件下可逆反应达到平衡时,生成物浓度的幂之积与反应物浓度幂之积的比值。所以该反应的平衡常数表达式为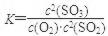 。过量的SO2与NaOH溶液反应生成物是酸式盐,方程式为SO2+NaOH===NaHSO3。
。过量的SO2与NaOH溶液反应生成物是酸式盐,方程式为SO2+NaOH===NaHSO3。
(2)因为Fe3+在溶液中易水解,所以为了抑制水解需要加入盐酸。
(3)因为溶液中可能会生成Fe2+,所以为了抑制其生成,需要加入氧化剂氯气,方程式为Cl2+2Fe2+===2Cl-+2Fe3+。
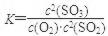 。过量的SO2与NaOH溶液反应生成物是酸式盐,方程式为SO2+NaOH===NaHSO3。
。过量的SO2与NaOH溶液反应生成物是酸式盐,方程式为SO2+NaOH===NaHSO3。(2)因为Fe3+在溶液中易水解,所以为了抑制水解需要加入盐酸。
(3)因为溶液中可能会生成Fe2+,所以为了抑制其生成,需要加入氧化剂氯气,方程式为Cl2+2Fe2+===2Cl-+2Fe3+。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

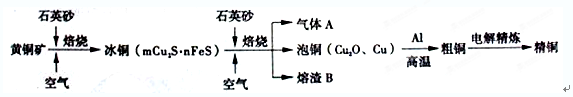
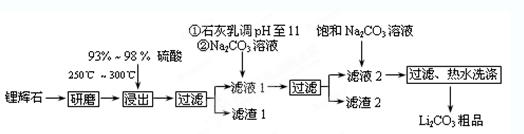
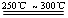 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓