题目内容
(12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
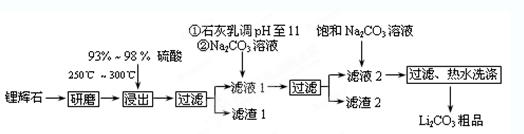
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓)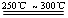 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。
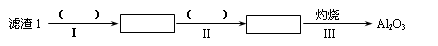
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
②b中,生成Li2CO3反应的化学方程式是______________________________。

已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓)
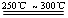 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓②某些物质的溶解度(S)如下表所示。
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
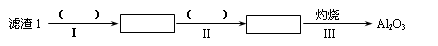
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
②b中,生成Li2CO3反应的化学方程式是______________________________。
(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(2)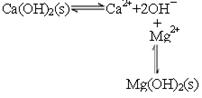 平衡右移,沉淀转变为Mg(OH)2
平衡右移,沉淀转变为Mg(OH)2
Mg2++Ca(OH)2=Mg(OH)2+Ca2+
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)①2Cl――2e―=Cl2↑ ②2LiOH+NH4HCO3=Li2CO3+NH3 .H2O+H2O
(2)
 平衡右移,沉淀转变为Mg(OH)2
平衡右移,沉淀转变为Mg(OH)2 Mg2++Ca(OH)2=Mg(OH)2+Ca2+
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)①2Cl――2e―=Cl2↑ ②2LiOH+NH4HCO3=Li2CO3+NH3 .H2O+H2O
(1)滤渣I中含有氧化铝和二氧化硅,由于二者都和氢氧化钠反应,所以要除去二氧化硅,应该用盐酸溶解氧化铝。过滤后向滤液中通入氨气即生成氢氧化铝沉淀,方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(2)石灰乳中存在平衡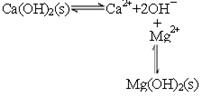 ,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg(OH)2,方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+。
,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg(OH)2,方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+。
(3)由于Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。
(4)①由于电解池中阳极失去电子,所以溶液中的氯离子在阳极放电,方程式为2Cl――2e―=Cl2↑。
②根据反应物和生成物可以写出反应的方程式为2LiOH+NH4HCO3=Li2CO3+NH3 .H2O+H2O 。
(2)石灰乳中存在平衡
 ,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg(OH)2,方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+。
,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg(OH)2,方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+。(3)由于Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。
(4)①由于电解池中阳极失去电子,所以溶液中的氯离子在阳极放电,方程式为2Cl――2e―=Cl2↑。
②根据反应物和生成物可以写出反应的方程式为2LiOH+NH4HCO3=Li2CO3+NH3 .H2O+H2O 。

练习册系列答案
相关题目

 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 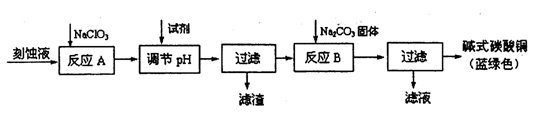

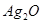 的方法冶炼
的方法冶炼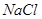 溶液方法冶炼
溶液方法冶炼