题目内容
(7分).福建有广阔的海岸线,建设海峡西岸经济区,海水的综合利用大有可为。海水中溴含量约为65 mg·L-1,从海水中提取溴的工业流程如下:
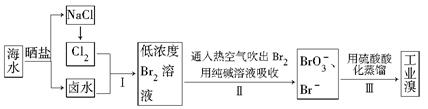
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是______
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:

(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:_______________ 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是______
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:

(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:_______________ 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
(1)富集(或浓缩)溴元素 (2)C (3)3 3 1 5 3
(4)SO2+Br2+2H2O===2HBr+H2SO4 (5)BD
(4)SO2+Br2+2H2O===2HBr+H2SO4 (5)BD
(1)由于海水中溴的含量很低,所以目的是富集(或浓缩)溴元素。
(2)单质溴极易挥发,因此热空气或水蒸气可以吹出Br2,答案选C。
(3)根据电子的得失守恒和质量守恒定律可知,配平后的化学计量数依次是3、3、1、5、3。
(4)单质溴具有氧化性,能氧化SO2,所以反应的方程式是SO2+Br2+2H2O===2HBr+H2SO4。
(5)选用的萃取剂的原则: ①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂。乙醇和水互溶,氢氧化钠能和溴单质反应,不能用作萃取剂,所以答案选BD。
(2)单质溴极易挥发,因此热空气或水蒸气可以吹出Br2,答案选C。
(3)根据电子的得失守恒和质量守恒定律可知,配平后的化学计量数依次是3、3、1、5、3。
(4)单质溴具有氧化性,能氧化SO2,所以反应的方程式是SO2+Br2+2H2O===2HBr+H2SO4。
(5)选用的萃取剂的原则: ①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂。乙醇和水互溶,氢氧化钠能和溴单质反应,不能用作萃取剂,所以答案选BD。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目

 Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
Al(OH)3+3H+的平衡常数为 (保留两位有效数字);
 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 
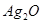 的方法冶炼
的方法冶炼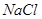 溶液方法冶炼
溶液方法冶炼