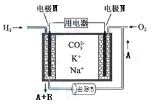
题目内容
【题目】有位于前四周期的A、B、C、D、E、F六种元素,它们的核电荷数依次增大。其中C、E、F是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)A是_____,B是_____,F是_____。(写元素符号)
(2)写出F元素基态原子的核外价电子排布图_____,其最高化合价为_____。
(3)含E元素的化合物灼烧的颜色是_____。很多金属盐都可以发生焰色反应,其原因是_____。
(4)请写出元素C的最高价氧化物对应的水化物与HClO4反应的离子方程式:_____。
(5)C与E的金属性强弱关系是C____E,请设计一个简单实验来证明:_____。
【答案】H O Sc ![]() +3 紫色 激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来 Al(OH)3+3H+=Al3++3H2O < 将两种金属单质分别投入冷水中,钾能和冷水发生剧烈反应而铝几乎不和水反应
+3 紫色 激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来 Al(OH)3+3H+=Al3++3H2O < 将两种金属单质分别投入冷水中,钾能和冷水发生剧烈反应而铝几乎不和水反应
【解析】
有位于前四周期的A、B、C、D、E、F六种元素,它们的核电荷数依次增大;B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E的原子序数大于硫,且6种元素中只有C、E、F是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6×![]() =3,故C为Al;F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,则价电子排布式为3d14s2,故F为Sc元素,据此分析解题。
=3,故C为Al;F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,则价电子排布式为3d14s2,故F为Sc元素,据此分析解题。
由上述分析可知,A为H、B为O、C为Al、D为S、E为K、F为Sc;
(1)由分析知:A是H,B是O,F是Sc;
(2)F元素为Sc,基态原子的核外价电子排布式为3d14s2,则价电子排布图![]() ,其最高化合价为+3价;
,其最高化合价为+3价;
(3)E为K元素,含钾元素的化合物灼烧的颜色是紫色;激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来,这就是很多金属盐都可以发生焰色反应的原因;
(4)C为Al,最高价氧化物的水化物为Al(OH)3,另外HClO4是强酸,则Al(OH)3与HClO4反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;
(5)将金属K和Al分别投入到盛有冷水的烧杯中,钾能和冷水发生剧烈反应而铝几乎不和水反应,则金属性Al<K。

 阅读快车系列答案
阅读快车系列答案【题目】实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
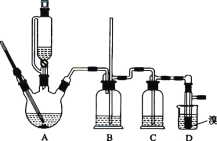
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm -3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A 中发生的化学方程式为 ________,反应类型为 ________,在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ________________(填字母)。
a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)装置B 的作用是 ________,在装置C 中应加入 ________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)装置D 中实验现象为 ________。
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置 D,其主要目的是 ________________;不用冰水原因 ________。
(6)若制得的产物中混有乙醚,得到纯净的产物的操作是________。
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |