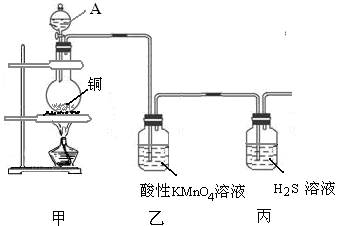
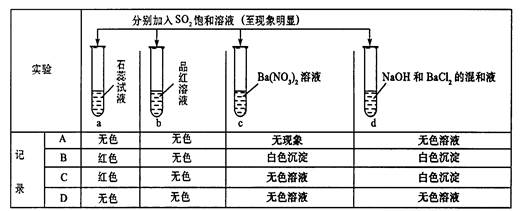
题目内容
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化荆和催化剂等。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____________________,此法的最大缺点是____________________________。
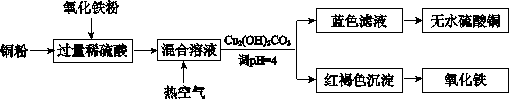
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
①稀硫酸、铜和氧化铁反应的离子方程式是__________________、________________;
向混合溶液中通入热空气的反应的离子方程式是_______________________________。
②请说出调整PH为4的目的是_______________________;由滤液得到无水硫酸铜的实验操作是______________________________。
工业制硫酸铜的方法很多。
(1)方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____________________,此法的最大缺点是____________________________。
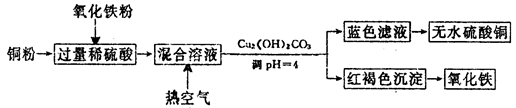
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

①稀硫酸、铜和氧化铁反应的离子方程式是__________________、________________;
向混合溶液中通入热空气的反应的离子方程式是_______________________________。
②请说出调整PH为4的目的是_______________________;由滤液得到无水硫酸铜的实验操作是______________________________。
(1)Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O 产生有污染的气体
CuSO4+SO2↑+2H2O 产生有污染的气体
(2)①Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 4Fe2++4H++O2=4Fe3++2H2O
② 使Fe3+完全沉淀 加热、蒸发
 CuSO4+SO2↑+2H2O 产生有污染的气体
CuSO4+SO2↑+2H2O 产生有污染的气体(2)①Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 4Fe2++4H++O2=4Fe3++2H2O
② 使Fe3+完全沉淀 加热、蒸发
试题分析:(1)铜和浓硫酸反应,生成CuSO4、SO2、H2O,进而得出化学方程式;缺点是产生二氧化硫污染空气。
(2)①Fe2O3与H2SO4反应生成Fe2(SO4)3和H2O,Cu把Fe3+还原为Fe2+;热空气中的O2在酸性条件下,把Fe2+氧化为Fe3+,进而可得离子方程式。
②pH为4时,Fe3+完全水解转化为Fe(OH)3沉淀;对硫酸铜溶液进行加热、蒸发可得无水硫酸铜。

练习册系列答案
相关题目