题目内容
【题目】利用沉淀滴定法快速测定NaBr等卤化物溶液中c(Br-),实验过程包括标准溶液的配制和滴定待测溶液。
I.标准溶液的配制
准确称取AgNO3基准物8.5g,配制成500mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定的主要步骤
a.取待测NaBr溶液25.00mL,配制成100mL溶液,取其中25.00mL于锥形瓶中。
b.加入K2CrO4溶液作指示剂。
c.用AgNO3标准溶液进行滴定,记录消耗的体积。
d.重复上述操作三次,测定数据如下表:

e.数据处理。
请回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯和玻璃棒外还有___,配制的AgNO3溶液的浓度为___。
(2)AgNO3标准溶液应使用___ (填“酸式”或“碱式”)棕色滴定管,检漏后装液前需要进行的操作有___。
(3)实验可用铬酸钾(K2CrO4)作指示剂,一方面,是由于Ag2CrO4是砖红色沉淀,现象变化明显,另一方面,是由于___。
(4)滴定应在近中性或弱碱性(6.5<pH<10.5)的条件下进行,其原因是酸性过强,发生如下离子反应:___;碱性过强,会导致___。
(5)达到滴定终点时的现象为___。
(6)由上述实验数据测得原溶液c(Br-)=___ mol·L-1。
(7)若在配制AgNO3标准溶液时,未洗涤玻璃棒和烧杯,则对c(Br-)测定结果的影响为___ (填“偏高”“偏低”或“无影响”)。
【答案】500 mL(棕色)容量瓶、胶头滴管 0.1mol/L 酸式 洗涤、润洗 AgBr比Ag2CrO4更难溶,在相同浓度的Ag+溶液中Br-比CrO42-更易结合Ag+生成沉淀 2CrO42-+2H+![]() Cr2O72-+H2O Ag+易结合OH-生成Ag2O沉淀,影响实验测定 滴入最后一滴标准溶液,锥形瓶中产生了砖红色沉淀,且30 s内不消失 0.4 偏高
Cr2O72-+H2O Ag+易结合OH-生成Ag2O沉淀,影响实验测定 滴入最后一滴标准溶液,锥形瓶中产生了砖红色沉淀,且30 s内不消失 0.4 偏高
【解析】
该滴定实验的原理为:根据反应Br-+Ag+=AgBr↓,通过消耗的硝酸银标准液的量来确定待测液中Br-的量,当Br-完全反应后,继续滴加硝酸银,银离子与CrO42-反应生成砖红色沉淀,即可确定滴定终点。
(1)配制硝酸银标准溶液时,所使用的玻璃仪器除需烧杯和玻璃棒外还有500 mL(棕色)容量瓶及定容时需要的胶头滴管;c(AgNO3)=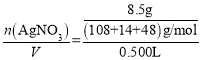 =0.1mol/L;
=0.1mol/L;
(2)AgNO3溶液显酸性,且一般加少量HNO3酸化,需用酸式滴定管;检漏后装液前需要进行洗涤、润洗等操作;
(3)实验可用铬酸钾(K2CrO4)作指示剂,说明AgBr比Ag2CrO4更难溶,在相同浓度的Ag+溶液中Br-比CrO42-更易结合Ag+生成沉淀;
(4)酸性过强,指示剂CrO42-会转变为Cr2O72-,从而影响滴定终点的判断离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O;碱性过强,Ag+易生成Ag2O沉淀,影响实验测定结果;
Cr2O72-+H2O;碱性过强,Ag+易生成Ag2O沉淀,影响实验测定结果;
(5)根据分析可知,滴定终点的现象为:滴入最后一滴标准溶液,锥形瓶中产生了砖红色沉淀,且30 s内不消失;
(6)根据所提供的4次数据,第1次数据误差值较大,应舍去,所以消耗的AgNO3溶液的平均体积为![]() =25.00mL,根据方程式Br-+Ag+=AgBr↓可知稀释后的NaBr溶液中c(Br-)=
=25.00mL,根据方程式Br-+Ag+=AgBr↓可知稀释后的NaBr溶液中c(Br-)=![]() =0.1mol/L,该溶液是由25mL稀释成100mL,所以原溶液中c(Br-)=0.4mol/L;
=0.1mol/L,该溶液是由25mL稀释成100mL,所以原溶液中c(Br-)=0.4mol/L;
(7)若在配制AgNO3标准溶液时,未洗涤玻璃棒和烧杯,会导致硝酸银标准液的浓度偏低,从而使测定的标准液体积偏大,进而使溴离子浓度偏大。