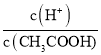题目内容
【题目】完成下列有关物质的量的计算
(1)![]() 个
个![]() 分子的物质的量是________
分子的物质的量是________![]() 。
。
(2)标准状况下,![]() 的体积是_________L。
的体积是_________L。
(3)含有相同氧原子数的![]() 和
和![]() ,其分子的质量比为_________。
,其分子的质量比为_________。
(4)标准状况下,![]() 气体溶于水配制成
气体溶于水配制成![]() 溶液,其物质的量浓度为_______
溶液,其物质的量浓度为_______![]() 。
。
(5)![]() 碳在一定量的氧气中完全燃烧,反应后生成
碳在一定量的氧气中完全燃烧,反应后生成![]() 和
和![]() 混合气体的平均摩尔质量是
混合气体的平均摩尔质量是![]() ,则生成的
,则生成的![]() 的质量是_____
的质量是_____![]() 。
。
【答案】0.2 44.8 6:5 ![]() 6.3
6.3
【解析】
(1)根据n=![]() 计算;
计算;
(2) 根据n=![]() =
=![]() 分析计算;
分析计算;
(3) 根据n=![]() =
=![]() 结合分子构成判断;
结合分子构成判断;
(4) 根据n=![]() ,再结合c=
,再结合c=![]() 计算;
计算;
(5)依据n=![]() 计算碳物质的量,结合碳元素守恒可知二氧化碳和一氧化碳物质的量与碳物质的量相同,根据摩尔质量概念计算。
计算碳物质的量,结合碳元素守恒可知二氧化碳和一氧化碳物质的量与碳物质的量相同,根据摩尔质量概念计算。
(1)n=![]() =
=![]() 0.2mol,
0.2mol,![]() 分子的物质的量是0.2mol;
分子的物质的量是0.2mol;
(2)![]() 的物质的量=
的物质的量=![]() =2mol,标准状况下,体积=2mol ×22.4L/mol=44.8L;
=2mol,标准状况下,体积=2mol ×22.4L/mol=44.8L;
(3)含有相同氧原子数的SO2和SO3,物质的量之比为3:2,则分子质量之比为3×64:2×80=6:5;
(4)标准状况下,![]() 气体的物质的量=
气体的物质的量=![]() =
=![]() ,溶于水配制成
,溶于水配制成![]() 溶液,其物质的量浓度为
溶液,其物质的量浓度为![]() =
=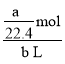 =
=![]()
![]() ;
;
(5) 3.6g碳物质的量=![]() =0.3mol,反应后生成CO和CO2混合气体物质的量为0.3mol,混气体平均摩尔质量是32g/mol,则混合气体质量=32g/mol×0.3mol=9.6g,设一氧化碳物质的量为x,二氧化碳物质的量为(0.3x)mol,28x+44(0.3x)=9.6,x=0.225mol,一氧化碳质量=0.225mol×28g/mol=6.3g。
=0.3mol,反应后生成CO和CO2混合气体物质的量为0.3mol,混气体平均摩尔质量是32g/mol,则混合气体质量=32g/mol×0.3mol=9.6g,设一氧化碳物质的量为x,二氧化碳物质的量为(0.3x)mol,28x+44(0.3x)=9.6,x=0.225mol,一氧化碳质量=0.225mol×28g/mol=6.3g。

练习册系列答案
相关题目