题目内容
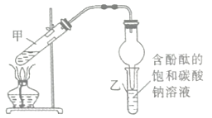
【题目】在强热条件下,硫酸亚铁固体可发生如下反应:2FeSO4![]() Fe2O3+SO2↑+SO3↑。若将此反应生成的气体先通入足量BaCl2溶液,再通入品红溶液中,则可能的现象为( )
Fe2O3+SO2↑+SO3↑。若将此反应生成的气体先通入足量BaCl2溶液,再通入品红溶液中,则可能的现象为( )
①BaCl2溶液中无沉淀析出;
②析出BaSO3沉淀;
③析出BaSO4沉淀;
④品红溶液褪色;
⑤品红溶液不褪色;
A.①④B.②④C.②③⑤D.③④
【答案】D
【解析】
①SO3能与BaCl2溶液反应,有沉淀析出,①不正确;
②SO2与BaCl2溶液不反应,没有BaSO3沉淀析出,②不正确;
③SO3能与BaCl2溶液反应,析出BaSO4沉淀,③正确;
④SO2具有漂白性,能使品红溶液褪色,④正确;
⑤SO2具有漂白性,品红溶液的红色褪去,⑤不正确;
综合以上分析,③④符合题意,故选D。

练习册系列答案
相关题目
【题目】下列有关物质检验的实验,结论正确的是( )
实验操作 | 现象 | 实验结论 | |
A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有 |
B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有 |
A.AB.BC.CD.D