题目内容
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有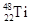 和
和 两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
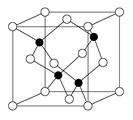
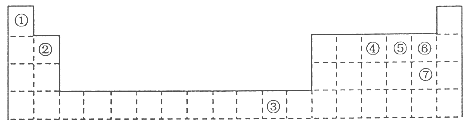
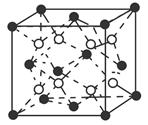
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是 ;

(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:
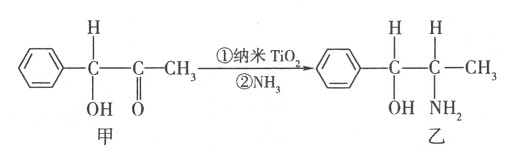
化合物甲的分子中采取sp2杂化的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 。
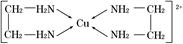
(4)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5] 2+ 中含有的化学键类型是 ,该配合物的配体是 。
(1)钛有
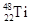 和
和 两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
两种原子,它们互称为 ,钛基态原子的电子排布式为 ;(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是 ;

(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:

化合物甲的分子中采取sp2杂化的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 。
(4)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5] 2+ 中含有的化学键类型是 ,该配合物的配体是 。
(1)同位素(1分)1s22s22p63s23p63d24s2(1分)
(2)TiBaO3(2分)
(3)7(2分) N>O>C(2分)
(4)极性键(或共价键)、配位键;(2分)H2O、Cl-(2分)
(2)TiBaO3(2分)
(3)7(2分) N>O>C(2分)
(4)极性键(或共价键)、配位键;(2分)H2O、Cl-(2分)
试题分析:(1)质子数相同而中子数不同的原子,故为同位素;钛核外电子数为22,根据核外电子的排布原则可得电子排布式。(2)氧原子处于棱上,被四个这样的晶胞所共用,故12×1/4=3,钛原子位于顶点上,被8个这样的小立方体所共用,故8×1/8=1,钡原子位于立方体的中心,完全属于这个晶胞,根据三者的原子个数比可得化学式。(3)苯环上的碳原子均采取sp2杂化,碳氧双键中的碳原子也是sp2杂化,故7个;化合物乙中的碳原子、氮原子、氧原子均采取sp3杂化,氮原子外层p能级上是半充满结构,稳定,难失去电子,故第一电离能比氧原子大。(4)配离子[TiCl(H2O)5] 2+中水分子中有极性键,Ti3+和氯原子及水分子均形成配位键,故配体为氯原子和水分子。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 键与
键与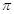 键数目之比为 。
键数目之比为 。

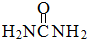 )中
)中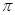 键与
键与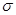 键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-