题目内容
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关。回答下列问题。
(1)写出硅原子的电子排布式________。C、Si、N的电负性由大到小的顺序是________。
(2)氟化氢水溶液中存在的氢键有________种。

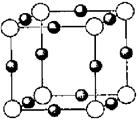
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是________________________。
(1)写出硅原子的电子排布式________。C、Si、N的电负性由大到小的顺序是________。
(2)氟化氢水溶液中存在的氢键有________种。

(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是________________________。
(1)1s22s22p63s23p2 N>C>Si
(2)4 (3)3∶1
(4)结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子需要的能量大小顺序为N60>C60>Si60
(2)4 (3)3∶1
(4)结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子需要的能量大小顺序为N60>C60>Si60
(2)HF、H2O均能形成氢键:H—F…H—F、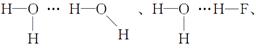 H—O—H…F—H共四种。
H—O—H…F—H共四种。
(3)K处于晶胞表面:12× =6,C60处于晶胞顶点和体心:8×
=6,C60处于晶胞顶点和体心:8× +1=2。故K原子和C60分子的个数比为:6∶2=3∶1。
+1=2。故K原子和C60分子的个数比为:6∶2=3∶1。
(4)熔点与分子间作用力大小有关,而破坏分子则是破坏分子内的共价键。
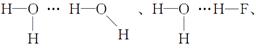 H—O—H…F—H共四种。
H—O—H…F—H共四种。(3)K处于晶胞表面:12×
 =6,C60处于晶胞顶点和体心:8×
=6,C60处于晶胞顶点和体心:8× +1=2。故K原子和C60分子的个数比为:6∶2=3∶1。
+1=2。故K原子和C60分子的个数比为:6∶2=3∶1。(4)熔点与分子间作用力大小有关,而破坏分子则是破坏分子内的共价键。

练习册系列答案
相关题目
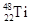 和
和 两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
两种原子,它们互称为 ,钛基态原子的电子排布式为 ;



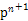 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。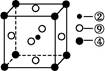
 CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。
CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。  为碳原子,
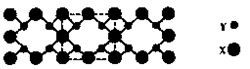
为碳原子, 为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。