题目内容
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类。
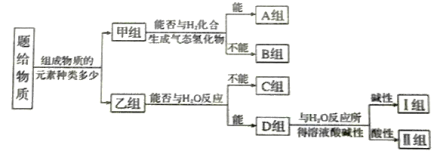
请回答下列问题:
(1)SO2属于_______________(填“酸性氧化物”、“碱性氧化物”、“两性氧化物”)。
(2)Na2O2最终位于________组;它的电子式为____________。
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式:__________________________。
(4)II组的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为_____________。
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有0.8NA个电子转移则有_________g该物质参与反应。
(6)N2H4是一种高能燃料,有强还原性,可通过I组的某种物质和NaClO反应制得,该制备反应的化学方程式为______________________。
【答案】酸性氧化物 Ⅰ ![]() 3CO+Fe2O3
3CO+Fe2O3![]() 2Fe+3CO2 2:1 16.8 NaClO+2NH3=N2H4+NaCl+H2O
2Fe+3CO2 2:1 16.8 NaClO+2NH3=N2H4+NaCl+H2O
【解析】
NH3、CO、Na、Na2O2、Fe、NO、NO2,F2、SO2等,按照组成元素的多少分为单质和化合物,属于单质的是Na、Fe、F2,属于化合物的是NH3、CO、Na2O2、NO、NO2、SO2;单质中能与氢气反应的是F2;化合物中能与水反应的是NH3、Na2O2、NO2、SO2,反应后溶液显碱性的是NH3、Na2O2;
(1)SO2能与碱反应生成盐和水;
(2)Na2O2能与水反应生成NaOH和O2,反应后溶液显碱性;
(3)C组有一种气体常用作工业上冶炼铁的还原剂是CO;
(4)Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,根据化合价的变化分析;
(5)B组中与水在高温条件下反应的物质为Fe,结合反应方程式计算;
(6) NaClO溶液和NH3发生氧化还原反应生成氯化钠和肼,根据反应物和生成物写出反应方程式。
(1)SO2能与碱反应生成盐和水,则属于酸性氧化物;
(2)Na2O2能与水反应,且反应后所得溶液显碱性,则最终位于Ⅰ组;Na2O2是离子化合物,其电子式为![]() ;
;
(3) C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3在高温条件下生成Fe和二氧化碳,反应方程式为Fe2O3+3CO ![]() 2Fe+3CO2;
2Fe+3CO2;
(4) ))Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,所以被氧化的NO2与被还原的NO2的物质的量之比为2:1;
(5) B组中与水在高温条件下反应的物质为Fe,反应的方程式为4H2O(g)+3Fe![]() Fe3O4+4H2,该反应过程中有8NA个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g/mol=168g,若该反应过程中有0.8NA个电子转移,消耗Fe为168g×
Fe3O4+4H2,该反应过程中有8NA个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g/mol=168g,若该反应过程中有0.8NA个电子转移,消耗Fe为168g×![]() =16.8g;
=16.8g;
(6) 该反应中,次氯酸钠被氨气还原生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O。