题目内容
【题目】下列叙述中正确的是( )
A.钢铁发生电化学腐蚀时,正极上发生的反应为 Fe-2e-=Fe2+
B.用惰性电极分别电解熔融的NaCl和饱和食盐水时,阳极的电极反应式均为:2Cl- -2e-=Cl2↑
C.铜锌原电池工作时,若有13 克锌被溶解,外电路就有0.2 mol电子通过
D.电解精炼铜时,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液
【答案】BD
【解析】
A. 钢铁发生电化学腐蚀时,负极上Fe失去电子,发生氧化反应,电极反应式为为Fe-2e-=Fe2+,A错误;
B. 用惰性电极电解熔融NaCl时,阴极上发生反应:2Cl- -2e-=Cl2↑;用惰性电极电解饱和食盐水时,由于阴离子放电能力Cl->OH-,所以阴极上发生反应:2Cl- -2e-=Cl2↑,B正确;
C. 13 g Zn的物质的量为n(Zn)=![]() =0.2 mol,由于Zn是+2价金属,所铜锌原电池工作时,若有13 g锌被溶解,外电路就会有0.2 mol×2=0.4 mol电子通过,C错误;
=0.2 mol,由于Zn是+2价金属,所铜锌原电池工作时,若有13 g锌被溶解,外电路就会有0.2 mol×2=0.4 mol电子通过,C错误;
D. 电解精炼铜时,要以粗铜作阳极,纯铜作阴极,含有Cu离子的溶液如硫酸铜溶液作电解质溶液,D正确;
故合理选项是BD。

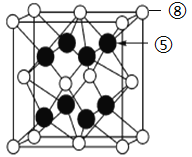
【题目】下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
主族 周期 | ⅠA | 0族 | ||||||
一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
二 | ② | |||||||
三 | ③ | ④ | ⑤ | ⑥ | ||||
(1)最活泼的金属元素是_______________(填元素符号)
(2)②和⑤两种元素原子半径较大的是_______________(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是_____________(填元素符号);
(3)写出①的单质在⑥的单质中燃烧的化学方程式_______________________________________ 。
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |