题目内容
(8分)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,
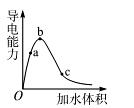
(1)O点导电能力为0的理由是 。
(2)a、b、c三点溶液的c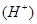 由小到大的顺序是 。
由小到大的顺序是 。
(3)a、b、c三点醋酸的电离程度最大的是 。
(4)要使c点c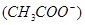 增大,c
增大,c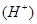 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法)
① ;② ;③ 。

(1)O点导电能力为0的理由是 。
(2)a、b、c三点溶液的c
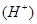 由小到大的顺序是 。
由小到大的顺序是 。(3)a、b、c三点醋酸的电离程度最大的是 。
(4)要使c点c
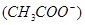 增大,c
增大,c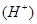 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法) ① ;② ;③ 。
(8分) (1) (1分)在O点醋酸未电离,无自由离子存在
(2) (2分)c<a<b (3) (2分)c点
(4) (3分)加NaOH固体 加少量的碳酸钠固体 加入镁等金属 加醋酸钠固体等
(2) (2分)c<a<b (3) (2分)c点
(4) (3分)加NaOH固体 加少量的碳酸钠固体 加入镁等金属 加醋酸钠固体等
试题分析:(1)冰醋酸在O点未能电离,不存在自由移动的离子,因此导电性未0。
(2)溶液的导电性越强,溶液中氢离子浓度越大,所以a、b、c三点溶液的c
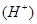 由小到大的顺序是c<a<b。
由小到大的顺序是c<a<b。(3)醋酸是弱酸,存在电离平衡,稀释促进电离。所以a、b、c三点醋酸的电离程度最大的是c点。
(4)根据醋酸的电离方程式CH3COOH
 CH3COO-+H+可知,要使c点c
CH3COO-+H+可知,要使c点c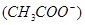 增大,c
增大,c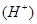 减少,可采取的措施有加NaOH固体或加少量的碳酸钠固体或加入镁等金属,或加醋酸钠固体等。
减少,可采取的措施有加NaOH固体或加少量的碳酸钠固体或加入镁等金属,或加醋酸钠固体等。点评:在判断溶液的导电性时,需要注意的是,溶液的导电性只与溶液中离子浓度大小和离子所带电荷数有关系,离子浓度越大,电荷数越多,溶液的导电性越强,据此可以进行有关判断。

练习册系列答案
相关题目
 、
、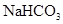 混合溶液中,各种离子浓度关系正确的是 ( )
混合溶液中,各种离子浓度关系正确的是 ( )



