题目内容
18.为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:(1)装置A的锥形瓶中装的溶液为碳酸钠溶液,分液漏斗中所盛试剂应为盐酸.
(2)装置B所盛的试剂是碳酸氢钠溶液,其作用是除去二氧化碳中混有的HCl.
(3)装置C所盛的试剂是硅酸钠溶液,C中反应的离子方程式CO2+H2O+SiO32-=CO32-+H2SiO3↓.
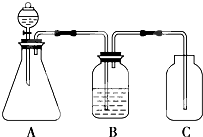
(4)这三种酸的酸性由强到弱的顺序为HCl>H2CO3>H2SiO3.
分析 根据较强酸制取较弱酸可知,较强酸能和较弱酸盐反应生成较弱酸,较弱酸能制取更弱的酸,要想验证HCl、H2CO3、H2SiO3的酸性强弱,用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,根据实验现象确定酸的相对强弱.
(1)较强的酸能制取较弱的酸,较弱的酸能制取最弱的酸,以此来确定锥形瓶、分液漏斗中的试剂;
(2)B装置中应盛放能吸收杂质的药品,且不能导致气体中引进新的杂质;
(3)装置C所盛的试剂为硅酸钠,与二氧化碳反应可生成硅酸沉淀;
(4)比较HCl、H2CO3和H2SiO3的酸性强弱,根据较强酸制取较弱酸结合装置A、B、C的反应分析.
解答 解:(1)用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,因此装置A的锥形瓶中装的溶液为碳酸钠溶液,分液漏斗中的试剂为盐酸,
故答案为:碳酸钠溶液;盐酸;
(2)盐酸有挥发性,导致二氧化碳气体中含有HCl,会对实验造成干扰,所以B装置要盛放能除去HCl,且不引起二氧化碳产生新的杂质、不能和二氧化碳反应的药品,一般常用碳酸氢钠溶液,
故答案为:碳酸氢钠溶液;除去二氧化碳中混有的HCl;
(3)C为硅酸钠溶液,二氧化碳、水和硅酸钠反应生成碳酸钠和硅酸沉淀,所以看到有沉淀生成,用于验证碳酸的酸性强于硅酸,反应离子方程式为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,
故答案为:硅酸钠溶液;CO2+H2O+SiO32-=CO32-+H2SiO3↓;
(4)根据较强酸制取较弱酸可知,用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,酸性:HCl>H2CO3>H2SiO3,
故答案为:HCl>H2CO3>H2SiO3.
点评 本题考查了比较弱酸相对强弱的探究实验,题目难度中等,注意盐酸有挥发性,导致二氧化碳气体中含有HCl,会对实验造成干扰,侧重于考查学生对实验原理的把握.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
| 选项 | 操作或现象 | 实验目的 |
| A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
| B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
| D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
 ;
;
 2SO3.
2SO3.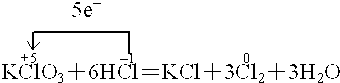 ;
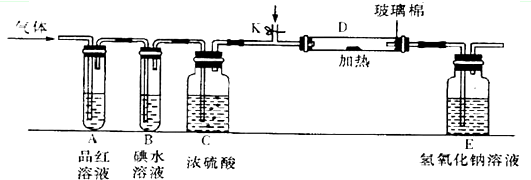
;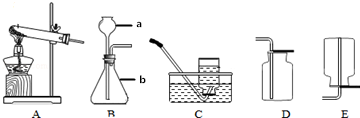 请根据下图装置回答
请根据下图装置回答