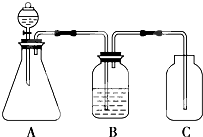
题目内容
13.用ωg氢氧化钠配制一定浓度的溶液来滴定盐酸,若氢氧化钠中混有碳酸钠,则测得盐酸的浓度是( )| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
分析 根据发生的反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaOH+HCl=NaCl+H2O,可知相同质量的碳酸钠、NaOH中,NaOH消耗HCl的物质的量更多,依据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$分析解答.
解答 解:由于氢氧化钠的性对分子量为40,而碳酸钠的相对分子质量为106,根据发生的反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaOH+HCl=NaCl+H2O,可知相同质量的碳酸钠、NaOH,NaOH消耗HCl的物质的量更多,故配制标准溶液的氢氧化钠中混有Na2CO3杂质,相当于标准的氢氧化钠的浓度偏小,消耗氢氧化钠溶液的体积偏大,依据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$可知测定盐酸的浓度偏高,
故选:A.
点评 本题考查了中和滴定误差分析,明确中和滴定原理,依据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$即可解答,题目难度不大.

练习册系列答案
相关题目
3.若要除去下列溶液中的杂质(括号内为杂质),请将选用的试剂及有关反应的化学方程式填入下表的空白处:
| 物质(杂质) | 试剂 | 有关化学方程式 |
| NaHCO3(Na2CO3) | CO2 | Na2CO3+H2O+CO2=2NaHCO3 |
| FeCl2(FeCl3) | Fe | 2FeCl3+Fe═3FeCl2 |
4.下列物质的保存方法正确的是( )
| A. | 氢氟酸保存在用塑料塞的玻璃瓶中 | |
| B. | 液溴盛放在用橡胶塞的玻璃瓶中 | |
| C. | 氯水贮存于棕色玻璃瓶中,密闭保存于阴凉处 | |
| D. | 硅酸钠溶液密封保存在玻璃塞的玻璃瓶中 |
8.写出下列物质溶于水时的电离方程式:
①Fe2(SO4)3Fe2(SO4)3═2Fe3++3SO42-;②NaHSO4NaHSO4═Na++H++SO42-;③KMnO4KMnO4═K++MnO4-.
①Fe2(SO4)3Fe2(SO4)3═2Fe3++3SO42-;②NaHSO4NaHSO4═Na++H++SO42-;③KMnO4KMnO4═K++MnO4-.
5.将5.32g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53gKNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是( )
| A. | -3 | B. | +4 | C. | +3 | D. | +2 |
9.某无色溶液能与铝作用放出H2,则下列离子组合中可能的是( )
| A. | H+、Cl-、Cu2+、Ba2+ | B. | OH-、NO${\;}_{3}^{-}$、Ba2+、Cl- | ||
| C. | H+、CO${\;}_{3}^{2-}$、Mg2+、Ba2+ | D. | OH-、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Mg2+ |
11.体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是( )
| A. | 分别与足量CaCO3反应时,放出的CO2一样多 | |
| B. | 与NaOH完全中和时,醋酸所消耗的NaOH多 | |
| C. | 两种溶液的pH相等 | |
| D. | 取等体积盐酸和CH3COOH溶液,分别加水稀释a倍和b倍,溶液的pH相等,则a<b |
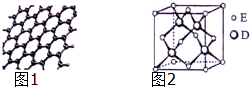 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题: