题目内容
9.A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性.(1)写出实验室制取E2反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)A、C元素按原子个数比为1:1形成化合物的电子式
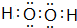 ;
;(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.
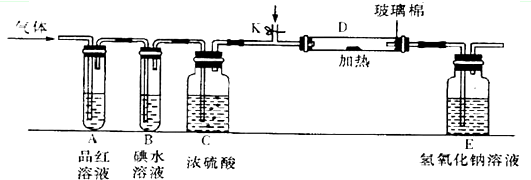
①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)相同;若装置D中装的是铁粉,当通入E2时D中观察到的现象为产生棕黄色的烟;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为2SO2+O2
 2SO3.
2SO3.②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl.
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)AC,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式S2O32-+Cl2+H2O=SO42-+S↓2Cl-+2H+.
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解.
①M的化学式为(NH4)2SO4•FeSO4•6H2O.
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为4a-2bmol/L.
分析 A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,则A为H元素;B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,且C的单质只有氧化性,则B为N元素、C为O元素、D为S元素、E为Cl.
(1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水;
(2)A、C元素按原子个数比为1:1形成化合物为H2O2;
(3)①二氧化硫能和品红化合生成无色物质,氯气与水反应生成次氯酸,次氯酸具有强氧化性,可以使品红溶液褪色;D中氯气与Fe反应生成氯化铁,生成棕黄色的烟;
若装置D中装的是五氧化二钒,当通入SO2时,打开K通入适量O2,反应生成三氧化硫;
②令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,据此书写方程式;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀);
(5)由元素S和O组成-2价酸根Z,Z中S与O的质量比为4:3,则n(S):n(O)=$\frac{4}{32}$:$\frac{3}{16}$=2:3,则Z为S2O23-,当Cl2与含S2O23-的溶液完全反应后,有浅黄色沉淀产生,说明生成S单质,取上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生,说明生成SO42-,氯气被还原为为Cl-,根据守恒配平书写离子方程式;
(6)由H、N、O三种元素组成的碱性物质N为NH3.H2O.由H、N、O、S和Fe五种元素组成的式量为392的化合物M,M的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体,过一段时间白色沉淀变为灰绿色,最终变为红褐色,可知Y中含有Fe2+、NH4+,NH4+为0.2mol,另取M的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则M中含有SO42-离子,n(SO42-)=n(BaSO4)=$\frac{46.6}{233g/mol}$=0.2mol,由硫酸根守恒可知,1molM含有1mol(NH4)2SO4、1molFeSO4,又1mol M中含有6mol结晶水,故M化学式为:(NH4)2SO4•FeSO4•6H2O,相对分子质量为392.
解答 解:A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,则A为H元素;B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,且C的单质只有氧化性,则B为N元素、C为O元素、D为S元素、E为Cl.
(1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)A、C元素按原子个数比为1:1形成化合物为H2O2,电子式为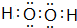 ,故答案为:
,故答案为: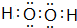 ;
;
(3)①二氧化硫与品红化合物无色物质,氯气与水反应生成次氯酸,次氯酸具有强氧化性,将品红氧化为无色物质,二氧化硫与氯气都可以是品红溶液褪色,在装置A中观察到的现象是相同;
氯气与铁反应产生棕黄色的烟;二氧化硫在五氧化二钒作催化剂、加热条件下与氧气反应生成三氧化硫,反应方程式为:2SO2+O2 2SO3,
2SO3,
故答案为:相同;产生棕黄色的烟;2SO2+O2 2SO3;
2SO3;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移的电子为5.0×10-5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀),
故选:AC;
(5)由元素S和O组成-2价酸根Z,Z中S与O的质量比为4:3,则n(S):n(O)=$\frac{4}{32}$:$\frac{3}{16}$=2:3,则Z为S2O23-,当Cl2与含S2O23-的溶液完全反应后,有浅黄色沉淀产生,说明生成S单质,取上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生,说明生成SO42-,氯气被还原为为Cl-,反应离子方程式为:S2O32-+Cl2+H2O=SO42-+S↓2Cl-+2H+,
故答案为:S2O32-+Cl2+H2O=SO42-+S↓2Cl-+2H+;
(6)由H、N、O三种元素组成的碱性物质N为NH3.H2O.由H、N、O、S和Fe五种元素组成的式量为392的化合物M,M的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体,过一段时间白色沉淀变为灰绿色,最终变为红褐色,可知Y中含有Fe2+、NH4+,NH4+为0.2mol,另取M的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则M中含有SO42-离子,n(SO42-)=n(BaSO4)=$\frac{46.6}{233g/mol}$=0.2mol,由硫酸根守恒可知,1molM含有1mol(NH4)2SO4、1molFeSO4,又1mol M中含有6mol结晶水,故M化学式为:(NH4)2SO4•FeSO4•6H2O,相对分子质量为392,
①由上述分析可知,M的化学式为:(NH4)2SO4•FeSO4•6H2O,故答案为:(NH4)2SO4•FeSO4•6H2O;
②N是NH3.H2O,测定浓度均为a mol/L的化合物N和M的混合溶液呈中性,且含金属离子的浓度为b mol/L,混合溶液中硫酸根离子浓度为2amol/L,根据电荷守恒得c(NH4+)+2c(Fe 2+ )=2c(SO42-),所以c(NH4+)=2c(SO42-)-2c(Fe 2+ )=2×2amol/L-2bmol/L=(4a-2b)mol/L,
故答案为:4a-2b.
点评 本题考查元素化合物推断、化学实验、元素化合物性质、常用化学用语、氧化还原反应应用等,(3)中注意根据电子转移守恒计算判断产物,侧重考查学生对知识的综合应用,难度较大.

| 选项 | 参数 | 比较 | 解释 |
| A | 还原性 | Br->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.005mol | B. | 0.01mol | C. | 0.025mol | D. | 0.03mol |
| A. | 吸热反应一定不可以自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |
| A. | 氢氟酸保存在用塑料塞的玻璃瓶中 | |
| B. | 液溴盛放在用橡胶塞的玻璃瓶中 | |
| C. | 氯水贮存于棕色玻璃瓶中,密闭保存于阴凉处 | |
| D. | 硅酸钠溶液密封保存在玻璃塞的玻璃瓶中 |
| A. | 1mol OH-含有的电子数为9NA | |
| B. | 常温常压下,NO2和N2O4的混合物23g中含有NA个氧原子 | |
| C. | 标准状况下,2.8gN2和2.24L CO所含电子数均为1.4NA | |
| D. | 标准状况下,22.4 L 乙醇中含有NA个乙醇分子 |
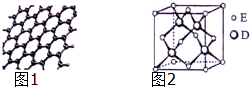 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题: