题目内容
8.热化学方程式:(1)热化学方程式的意义:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,表示温度在25度,压强101kp下,2molH2(g)和1molO2(g)完全反应生成2mol液态水时放出571.6KJ的热量.
(2)CH4的燃烧热为890.31kJ/mol,用热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31kJ•mol-1.
分析 (1)热化学方程式的系数表示物质的量的意义,方程式的系数和焓变是吻合的;
(2)燃烧热是指完全燃烧1mol物质生成稳定的氧化物所释放的热量,据热化学方程式的书写方法来回答.
解答 解:(1)热化学方程式的系数表示物质的量的意义,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,表示温度在25度,压强101kp下,2molH2(g)和 1molO2(g)完全反应生成2mol液态水时放出571.6KJ的热量,
故答案为:25;2mol;1mol;液态水;放出571.6KJ的热量;
(2)燃烧热是指完全燃烧1mol物质生成稳定的氧化物所释放的热量,CH4的燃烧热为890.31kJ/mol,用热化学方程式表示为:CH4(g)+2O2(g)=CO2 (g)+2H2O(l)△H=-890.31 kJ•mol-1,故答案为:CH4(g)+2O2(g)=CO2 (g)+2H2O(l)△H=-890.31 kJ•mol-1.
点评 本题考查了热化学方程式的书写原则和意义,燃烧热概念的分析判断,热化学方程式的计算应用,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列参数比较及解释均正确的是( )
| 选项 | 参数 | 比较 | 解释 |
| A | 还原性 | Br->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| B | 半径 | Na+<Mg2+<Al3+ | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| A. | A | B. | B | C. | C | D. | D |
16.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③3.4g NH3,这三种气体中氢原子个数从多到少的顺序表达正确的是( )
| A. | ①②③ | B. | ②③① | C. | ②①③ | D. | ①③② |
3.若要除去下列溶液中的杂质(括号内为杂质),请将选用的试剂及有关反应的化学方程式填入下表的空白处:
| 物质(杂质) | 试剂 | 有关化学方程式 |
| NaHCO3(Na2CO3) | CO2 | Na2CO3+H2O+CO2=2NaHCO3 |
| FeCl2(FeCl3) | Fe | 2FeCl3+Fe═3FeCl2 |
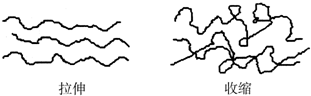
13.橡皮筋在拉伸和收缩状态时结构如图:在其拉伸过程中有放热现象,反之吸热.25℃、101kPa时,下列化学反应的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )

| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O | |
| C. | 2H2+O2═2H2O | |
| D. | CaCO3═CaO+CO2↑ |
20.为测某镁铝合金样品中铝的含量,某实验小组进行了下列实验:取一定量合金,加入100mL0.3mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再不断滴加0.2mol•L-1NaOH溶液至沉淀质量恰好在此时不再变化,用去350mL NaOH溶液.则所取样品中铝的物质的量为( )
| A. | 0.005mol | B. | 0.01mol | C. | 0.025mol | D. | 0.03mol |
17.下列有关说法正确的是( )
| A. | 吸热反应一定不可以自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |