题目内容
【题目】下列叙述中正确的是( )
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
C.常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
【答案】C
【解析】
A. 电镀池中,作阳极的是镀层金属,作阴极的是待镀金属;
B. 氯气与水的反应为可逆反应;
C. 由方程式可知该反应为熵增大的反应,根据复合判据确定ΔH的大小;
D. 向氨水中缓慢通入CO2,NH3H2O浓度减小,NH4+浓度增大,再结合电离常数进行分析判断。
A. 电镀池中,作阳极的是镀层金属,作阴极的是待镀金属,因此铜与电源的正极相连,铁与电源的负极相连,A项错误;
B. 氯气与水的反应为可逆反应,因此HClO、Cl-、ClO-粒子数之和小于2×6.02×1023,B项错误;
C. 由方程式可知该反应为熵增大的反应,根据复合判据可知,该反应ΔH>0,C项正确;
D. 向氨水中缓慢通入CO2,NH3H2O浓度减小,NH4+浓度增大,由于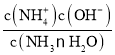 是常数,因此
是常数,因此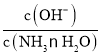 减小,D项错误;
减小,D项错误;
答案选C。

【题目】硫酸铜晶体(CuSO4·![]() H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量
H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量![]() 的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩埚质量 | 坩埚和晶体的质量 | 完全失去结晶水后坩埚和剩余固体的质量 |
11.685g | 13.691g | 12.948g |
(1)要完成此实验,至少要称量______次。
(2)![]() ______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
(3)造成本次误差可能的原因是______。
A. 加热时有晶体溅出
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质
C. 粉末未完全变白就停止加热
D. 加热后放在空气中冷却
(4)请写出造成本次误差还有可能存在的其他原因(写出其中一点)_____________________。
(5)如果硫酸铜晶体样品不纯,测定结果________。
A.没有偏差 B. 一定偏小 C. 一定偏大 D. 无法确定