题目内容
6.将如图所示实验装置的K闭合,下列判断正确的是( )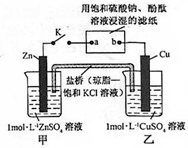
| A. | 片刻后甲池中c(SO42-)增大 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | Cu 电极上发生还原反应 | D. | 片刻后可观察到滤纸b点变红色 |
分析 甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动.
解答 解:甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,
A.锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,硫酸根离子不参加反应,所以硫酸根离子浓度不变,故A错误;
B.电子从Zn→a,b→Cu路径流动,电子不进入电解质溶液,故B错误;
C.铜电极上铜离子得电子发生还原反应而生成铜,故C正确;
D.电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故D错误;
故选C.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液是通过阴阳离子的定向移动形成电流,为易错点.

练习册系列答案
相关题目
14. 现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)⑩的溶液中滴入过量 ⑧的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
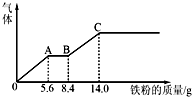
(3)⑤的稀溶液和⑨的混合溶液100mL,向其中逐渐加入②,产生气体的量随②质量增加的变化如下图所示.
回答下列问题:
①标准状况下,收集到的气体的总体积是4.48L.
②原混合溶液中硫酸的物质的量浓度是2.5mol/L.
(4)将⑤的稀溶液逐滴滴加到⑦中,实验现象是先生成红褐色沉淀,继续加入沉淀溶解.
 现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 电解质 |
| 属于该类的物质 |
(3)⑤的稀溶液和⑨的混合溶液100mL,向其中逐渐加入②,产生气体的量随②质量增加的变化如下图所示.
回答下列问题:
①标准状况下,收集到的气体的总体积是4.48L.
②原混合溶液中硫酸的物质的量浓度是2.5mol/L.
(4)将⑤的稀溶液逐滴滴加到⑦中,实验现象是先生成红褐色沉淀,继续加入沉淀溶解.
17.工业制备纯硅的反应:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=QkJ•mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应达平衡时,若升高温度,则硅的产量会提高 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入200mL 1mol•L-1的NaOH恰好反应 |
1.在一定条件下,一定量的A和B气体发生如下可逆反应:A(g)+3B(g)?3C(g),说明反应已到达平衡的是( )
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
11.酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )
| A. | R原子的电子层数比N的电子层数多1 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R和N元素的原子含有相同数目的未成对电子 |
18.关于氢键,下列说法正确的是( )
| A. | 每一个水分子内含有两个氢键 | |
| B. | 冰、水和水蒸气中都存在氢键 | |
| C. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
15.实验室进行下列实验时,要水浴加热的是( )
| A. | 乙醇和浓硫酸混合加热制乙烯 | |
| B. | 乙醛和新制Cu(OH)2加热,得砖红色沉淀 | |
| C. | 从石油中常压蒸馏提炼汽油 | |
| D. | 苯、浓硝酸、浓硫酸混合制硝基苯 |
 ;
;