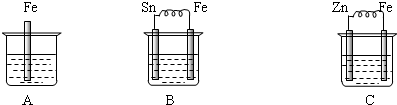
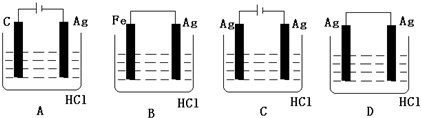
题目内容
11.酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )| A. | R原子的电子层数比N的电子层数多1 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R和N元素的原子含有相同数目的未成对电子 |
分析 酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则R原子电子数比N原子电子数多10,所以R原子核外电子数为17,则R为Cl元素.
A.R原子有3个电子层、N原子有2个电子层;
B.RO3-中R的化合价与NO3-中的N的化合价均为+5价;
C.元素处于最高价态时只有氧化性,处于中间价态时既有氧化性又有还原性;
D.Cl原子未成对电子为1,N原子为未成对电子数为3.
解答 解:酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则R原子电子数比N原子电子数多10,所以R原子核外电子数为17,则R为Cl元素.
A.R原子有3个电子层、N原子有2个电子层,R原子的电子层数比N的电子层数多1,故A正确;
B.由化合价规则可知,RO3-中R的化合价与NO3-中的N的化合价均为+5价,故B错误;
C.ClO3-中Cl元素化合价处于中间价态,既有氧化性又有还原性,NO3-中N元素处于最高价态,只有氧化性,故C错误;
D.Cl原子未成对电子为1,N原子为未成对电子数为3,故D错误,
故选A.
点评 本题考查原子结构和元素性质,题目难度不大,C中注意根据化合价判断ClO3-的性质,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.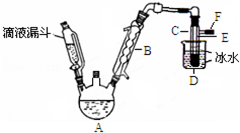 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
表.乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是abc(选填序号).
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发 d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式CH3CH2OH+NaBr+H2SO4NaHSO4+CH3CH2Br+H2O.
(3)仪器B的名称球形冷凝管,冷却水应从B的下(填“上”或“下”)口流进.
(4)反应生成的溴乙烷应在C中(填“A”或“C”中).
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列b(选填序号)溶液来洗涤产品.
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有分液漏斗、烧杯.
 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:表.乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发 d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式CH3CH2OH+NaBr+H2SO4NaHSO4+CH3CH2Br+H2O.
(3)仪器B的名称球形冷凝管,冷却水应从B的下(填“上”或“下”)口流进.
(4)反应生成的溴乙烷应在C中(填“A”或“C”中).
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列b(选填序号)溶液来洗涤产品.
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有分液漏斗、烧杯.
19.lmol某气态烃最多可与2molHCl发生加成反应,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要6molCl2,由此可知该烃结构简式可能为( )
| A. | CH3-CH━CH一CH3 | B. | CH3-C≡CH | C. | CH≡CH | D. | CH3-C≡C-CH |
6.将如图所示实验装置的K闭合,下列判断正确的是( )
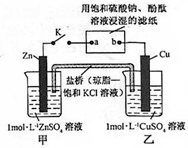

| A. | 片刻后甲池中c(SO42-)增大 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | Cu 电极上发生还原反应 | D. | 片刻后可观察到滤纸b点变红色 |
16.下列说法正确的是( )
| A. | 极性分子中一定没有非极性键 | B. | 非极性分子中一定不含极性键 | ||
| C. | 单质分子中一定存在非极性键 | D. | 极性分子中一定有极性键 |
3.有关卤代烃的说法正确的是( )
| A. | CH2=CHBr属于卤代烃 | |
| B. | 卤代烃密度都大于水 | |
| C. | 卤代烃都会水解生成醇 | |
| D. | 卤代烃都能和NaOH醇溶液发生消去反应 |
20.食品香精菠萝酯的生产路线(反应条件略去)如下,下列叙述正确是( )

| A. | 可用FeCl3溶液检验步骤(1)产物的是否有苯酚残留 | |
| B. | 可用溴水检验步骤(2)产物中是否有烯丙醇残留 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 苯氧乙酸和菠萝酯均可与溴水发生反应 |
1. 如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )
如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )
 如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )
如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )| A. | 压缩后U型管内两侧液面仍然保持水平 | |
| B. | 对于2NO2?N2O4平衡体系,向生成N2O4的方向移动 | |
| C. | 左侧气体颜色先变深后逐渐变浅(比原来深) | |
| D. | 若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |