题目内容
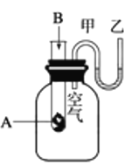
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为____________反应(填“放热”或“吸热”)。
(2)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(3)写出一个符合题中条件的化学方程式:_______________________
【答案】放热 低 2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或NaOH+HCl===NaCl+H2O等合理答案均可)
【解析】
试管中反应的热量变化与试管壁外的空气发生热量交换,广口瓶中的空气是我们研究的对象,再根据气体热胀冷缩的原理分析。
(1)因为“看到U形管中甲处液面下降乙处液面上升”,说明广口瓶中的空气体积增大,气压增大,这只能是A和B反应放出的热量传导给广口瓶中的空气造成的,由此推断A+B=C+D是放热反应;
(2)一个放热反应,一定是反应物断开化学键吸收的总能量小于生成物形成化学键释放的总能量,所以填“低”;
(3)所写化学方程式应符合:①常温常压下,两种反应物生成两种生成物;②放热反应。如2Al+6HCl==2AlCl3+3H2↑、2Na+2H2O==2NaOH+H2↑、NaOH+HCl==NaCl+H2O等。

练习册系列答案
相关题目