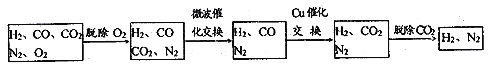
题目内容
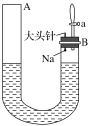
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法错误的是
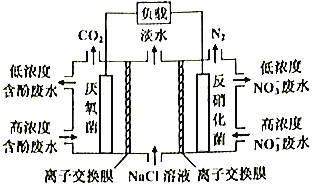
A. 左室电极为该电池的负极
B. 右室电极反应式可表示为:2NO3-+10e-+12H+=N2↑+6H2O
C. 左室电极附近溶液的pH增大
D. 工作时中间室的Cl-移向左室,Na+移向右室
【答案】C
【解析】
A.左室C6H5OH+11H2O-28e-=6CO2+28H+,失电子,为该电池负极,故不选A;
B.右室电极反应式可表示为:2NO3-+10e-+12H+=N2↑+6H2O,得电子,为该电池正极,故不选B;
C.左室C6H5OH+11H2O-28e-=6CO2+28H+,有H+生成,左室电极附近溶液的pH应该减小,故选C;
D.原电池工作时,阳离子向正极移动,阴离子向负极移动,所以工作时中间室的Cl-移向左室,Na+移向右室,故不选D;
正确答案:C。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%