题目内容
3.A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期且相邻,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.D、A按原子个数比3:2形成离子化合物丙.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:(1)B元素在周期表中的位置是第二周期第ⅥA族,乙物质的电子式是
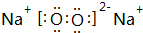 .
.(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是O<N<Al<Mg<Na(用元素符号填写).
(3)E的单质遇到A的最高价氧化物对应的水化物的浓溶液会发生钝化现象;但加入到C的最高价氧化物对应的水化物的溶液中能反应,反应的离子方程式是:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(4)丙与水反应生成两种碱性物质,试写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3 .
分析 A、B、C、D、E都是短周期元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E为Al,C、D、E同处另一周期,结合原子序数可知C为Na、D为Mg;C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则B为O,甲是Na2O,乙是Na2O2,D、A按原子个数比3:2形成离子化合物丙,则A为N元素,丙为Mg3N2,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E为Al,C、D、E同处另一周期,结合原子序数可知C为Na、D为Mg;C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则B为O,甲是Na2O,乙是Na2O2,D、A按原子个数比3:2形成离子化合物丙,则A为N元素,丙为Mg3N2.
(1)B为O元素,在周期表中的位置是第二周期第ⅥA族,乙是Na2O2,电子式为 ,
,
故答案为:第二周期第ⅥA族; ;
;
(2)同周期从左向右原子半径在减小,同主族自上而下原子半径增大,则原子半径为O<N<Al<Mg<Na,
故答案为:O<N<Al<Mg<Na;
(3)E的单质为Al,A的最高价氧化物对应的水化物为HNO3,Al在浓硝酸中发生钝化现象,C的最高价氧化物对应水化物为NaOH,Al与氢氧化钠反应生成偏铝酸钠与氢气,反应的离子方程式是:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:钝化;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)丙与水反应生成两种碱性物质,该反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3 ,故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3 .
点评 本题考查位置结构性质关系应用,元素的推断是答题的关键,注意对基础知识的理解掌握.

| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、SiO32-、NO3- | |
| B. | 0.1 mol•L-1 Na2CO3溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1NaClO溶液:Na+、NH4+、SO32-、CO32- | |
| D. | 0.1 mol•L-1Na[Al(OH)4]溶液:K+、Na+、SO42-、HCO3- |
| A. | 香烟烟气中只有尼古丁有毒 | |
| B. | 市售香烟通常装有过滤嘴,所以吸烟对人体无害 | |
| C. | 吸烟只影响自己的健康,不影响他人的健康 | |
| D. | 香烟烟气中的一氧化碳比氧气更容易与血红蛋白结合 |
| A. | 通入足量溴水中 | B. | 点燃 | ||
| C. | 催化加氢 | D. | 通入足量酸性KMnO4溶液中 |
| A. | 2.3 g钠与水反应产生氢气的分子数为0.05NA | |
| B. | 1 mol Fe与过量的稀HNO3反应,转移2NA个电子 | |
| C. | 0.1 mol/LNa2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4 L氯气与足量铜充分反应,生成1 mol CuCl2 |
 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )| A. | 13、7、1 | B. | 12、7、2 | C. | 1、7、13 | D. | 7、13、1 |
 .
.