题目内容
15.现代科学又发现了H3、C60、C90、C240、N5、N60 …,据此可做出的推测是( )①同一种元素可以形成多种单质
②单质可能存在复杂的分子结构
③单质的研究具有广阔的前景
④同种元素形成的单质之间可能存在更多的互相转化.
| A. | 只有①② | B. | 只有②③ | C. | 只有③④ | D. | ①②③④ |
分析 根据信息可知,同一一种元素可以形成多种不同的单质;单质是由同种元素种组成的纯净物,据此解答.
解答 解:①同一种元素可以形成多种不同的单质,例如碳元素可以形成C60、C90、C240,故正确;
②单质中可能含有多个原子,可能存在复杂的分子结构,例如C60,故正确;
③同一种元素可以形成多种单质,所以具有广阔的前景,故正确;
④同种元素形成的单质之间可能存在更多的相互转化,故正确;
故选D.
点评 本题考查了物质分类的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
3.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应过程中测定的部分数据如表:
下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol |
10.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如图方法制取.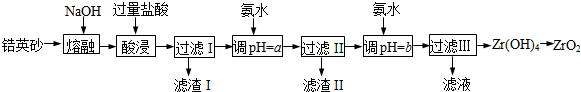
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表.
(1)熔融时ZrSiO4发生反应的化学方程式为ZrSiO4+4NaOH $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+Na2ZrO3+2H2O,滤渣I的化学式为H2SiO3.
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是5.2~6.2;继续加氨水至pH=b时,所发生反应的离子方程式为ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+.
(3)向过滤Ⅲ所得滤液中加入CaCO3粉末并加热,得到两种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净.

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表.
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是5.2~6.2;继续加氨水至pH=b时,所发生反应的离子方程式为ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+.
(3)向过滤Ⅲ所得滤液中加入CaCO3粉末并加热,得到两种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净.
7.已知乙醇可被强氧化剂直接氧化为乙酸.BrCH2CH=CHCH2Br可经三步反应制取HOOCCH(Cl)CH2COOH,其中第二步的反应类型是( )
| A. | 加成反应 | B. | 水解反应 | C. | 氧化反应 | D. | 消去反应 |
5.五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)请写出元素名称:X碳Y氮Z磷W硫M氯
(2)元素X位于周期表中第二周期ⅣA族;
(3)Y的最高价氧化物的水化物化学式为HNO3;
(4)元素Z可以形成多种单质,其中最常见两种名称分别是白磷、红磷;
(5)W原子的电子式是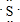 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.
(6)M的单质与水反应的化学方程式是Cl2+H2O═HCl+HClO.
| X | Y | ||
| Z | W | M |
(1)请写出元素名称:X碳Y氮Z磷W硫M氯
(2)元素X位于周期表中第二周期ⅣA族;
(3)Y的最高价氧化物的水化物化学式为HNO3;
(4)元素Z可以形成多种单质,其中最常见两种名称分别是白磷、红磷;
(5)W原子的电子式是
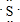 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.(6)M的单质与水反应的化学方程式是Cl2+H2O═HCl+HClO.
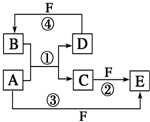 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).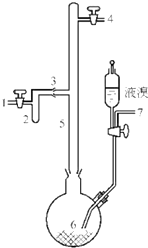 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].