题目内容
14.在标准状况下,将5.6L含NO、NO2和N2O4的混合气体及2.8L O2同时通入100mL 1.5mol/L Na2CO3溶液中恰好完全反应,并生成NaNO3和CO2,则混合气体中,N2O4与NO2的体积比是多少?分析 混合气体的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,n(O2)=$\frac{2.8L}{22.4L/mol}$=0.125mol,n(Na2CO3)=0.1L×1.5mol/L=0.15mol,结合质量守恒以及氧化还原反应得失电子守恒列式计算.
解答 解:混合气体的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,n(O2)=$\frac{2.8L}{22.4L/mol}$=0.125mol,n(Na2CO3)=0.1L×1.5mol/L=0.15mol,
设混合气体NO、NO2和N2O4的物质的量分别为x、y、z,
则$\left\{\begin{array}{l}{x+y+z=0.25}\\{x+y+2z=0.15×2(钠守恒)}\\{3x+y+2z=0.125×4(电子守恒)}\end{array}\right.$
解之得x=0.1,y=0.1,z=0.05,
则N2O4与NO2的体积比为2:1,
答:N2O4与NO2的体积比是2:1.
点评 本题考查了有关混合物的计算,侧重于学生的分析、计算能力的考查,难度不大,明确氧化还原反应中得失电子数相等是解本题的关键.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
5.下列有关叙述正确的是 ( )
| A. | 液化、汽化、风化、熔化等都属于物理变化 | |
| B. | 液化石油气、汽油、花生油主要成分都是碳氢化合物 | |
| C. | 水分子之间可以形成氢键,所以水比硫化氢稳定 | |
| D. | 提出原子在一定轨道上运动的原子结构模型是波尔 |
3.化学与生活密切相关.下列应用中利用了物质氧化性的是( )
| A. | 明矾净化水 | B. | 纯碱去油污 | C. | 食醋除水垢 | D. | 漂白粉漂白织物 |
4.己烷雌酚的一种合成路线如图:下列叙述正确的是( )

| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
 GTN{[Ni(CHZ)3](ClO4)2}是一种具有较强爆轰成长距离的初发药.
GTN{[Ni(CHZ)3](ClO4)2}是一种具有较强爆轰成长距离的初发药.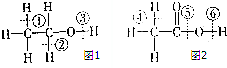 (1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.
(1)乙醇分子的结构式可表示如图1,在乙醇和钠反应时,③(填序号,下同)键断裂,在Cu催化和加热条件下与O2反应时,①②键断裂.