题目内容
9.标准状况下,将1L由CO和某气态烷烃组成的混合气体与9L氧气混合点燃,充分燃烧后,压强不变.温度为409.5K时,反应后气体的体积为15L.试求该烷烃的化学式及该烷烃在原混合气体中的体积分数.分析 将反应后15L气体(此时生成的H20在100℃以上为气态)换算成标准状况下的体积,压强一定时:$\frac{{V}_{0}}{{T}_{0}}=\frac{{V}_{1}}{{T}_{1}}$,所以V0=$\frac{273}{409.5}$×15=10L,因此表明反应前后气体总体积不变,设烷烃分子式为CnH2n+2,体积为xL,则CO体积为(1-x)L.2CO+O=2CO2△V(减少)
2 1 2 1
(1-x) $\frac{1-x}{2}$
CnH2n+2+$\frac{3n+1}{2}$O2→nCO2+(n+1)H2O△V
1 $\frac{3n+1}{2}$ n n+l $\frac{n-1}{2}$
x $\frac{(n-1)x}{2}$
依题意$\frac{1-x}{2}$=$\frac{(n-1)x}{2}$(x<1)
x=$\frac{1}{n}$
由此分析讨论解答.
解答 解:将反应后15L气体(此时生成的H20在100℃以上为气态)换算成标准状况下的体积,压强一定时:$\frac{{V}_{0}}{{T}_{0}}=\frac{{V}_{1}}{{T}_{1}}$,所以V0=$\frac{273}{409.5}$×15=10L,因此表明反应前后气体总体积不变,设烷烃分子式为CnH2n+2,体积为xL,则CO体积为(1-x)L.2CO+O=2CO2△V(减少)
2 1 2 1
(1-x) $\frac{1-x}{2}$
CnH2n+2+$\frac{3n+1}{2}$O2→nCO2+(n+1)H2O△V
1 $\frac{3n+1}{2}$ n n+l $\frac{n-1}{2}$
x $\frac{(n-1)x}{2}$
依题意$\frac{1-x}{2}$=$\frac{(n-1)x}{2}$(x<1)
x=$\frac{1}{n}$
由此讨论:又烷烃在常温下为气态,所以n≤4,则
当n=1时,x=1,不合理;
当n=2时,x=$\frac{1}{2}$,合理,此时烷烃的化学式为C2H6,在原混合气体中的体积分数50%;
当n=3时,x=$\frac{1}{3}$合理,此时烷烃的化学式为C3H8,在原混合气体中的体积分数33.3%;
当n=4时,x=$\frac{1}{4}$,合理,此时烷烃的化学式为C4H10,在原混合气体中的体积分数25%;答:①烷烃的化学式为C2H6,在原混合气体中的体积分数50%; ②烷烃的化学式为C3H8,在原混合气体中的体积分数33.3%; ③烷烃的化学式为C4H10,在原混合气体中的体积分数25%.
点评 本题考查混合物的计算以及有机物分子式的确定,本题的关键是将温度为409.5K时,反应后气体的体积为15L转化为标准状况下的体积,然后分析讨论,题目有一定的难度.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
| A. | 若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为(NH4)2SO4 | |
| B. | 若A和B都是盐,A难溶于水,而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为NaHSO4 | |
| C. | 若A是2:1 型的离子化合物,B是硫酸盐,D既可溶于稀盐酸又可溶于NaOH溶液,且A与B的物质的量之比为3:1时恰好完全反应,则B的化学式为Al2(SO4)3 | |
| D. | 若A是1:1型的离子化合物,A与过量的B溶液反应才有D生成;将C燃烧的产物通过装有碱石灰的干燥管或盛有浓硫酸的洗气瓶,两者的质量都增加,则B的化学式一定为Al2(SO4)3 |
| A. | 0.1mol•L-1 HA溶液与0.1 mol•L-1的NaOH溶液中,水电离出来的c(H+)相等 | |
| B. | 混合后溶液中:c(HA)>c(Na+)>c(A-)>c(OH-) | |
| C. | 混合后溶液中:c(A-)+c(HA)=0.2 mol•L-1 | |
| D. | 混合后溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) |
| A. | C99H200 | B. | CO | C. | NaHCO3 | D. | CH3COOCH2CH3 |
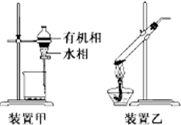
| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 中和滴定时,滴定管用所盛装的反应液润洗2~3次 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |

