题目内容
11.在原子序数1~20号元素中,按下列要求用合适的化学用语填空:(1)原子半径最小的元素是H;
(2)与水反应最剧烈的金属是K;
(3)气态氢化物最稳定的化合物是HF;
(4)最高价氧化物对应的水化物酸性最强的是HClO4;
(5)最高价氧化物对应的水化物呈两性的是Al(OH)3.
分析 (1)所有元素中氢原子半径最小;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,金属性越强,单质与水反应越剧烈;
(3)同周期自左而右金属性非金属性增强、同主族自上而下非金属性减弱,非金属性越强,对应氢化物越稳定;
(4)最高价含氧酸的酸性最强的是高氯酸;
(5)氢氧化铝为两性氢氧化物.
解答 解:(1)所有元素中氢原子半径最小,故答案为:H;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,故K的金属性最强,K与水反应最剧烈,故答案为:K;
(3)同周期自左而右金属性非金属性增强、同主族自上而下非金属性减弱,故F的非金属性最强,故HF最稳定,故答案为:HF;
(4)最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(5)中学常见最高价氧化物对应的水化物呈两性的是:Al(OH)3,故答案为:Al(OH)3.
点评 本题考查元素周期律应用,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
1.下列有关说法正确的是( )
| A. | 淀粉、油脂、蛋白质都能水解,其产物均不相同 | |
| B. | 用高锰酸钾溶液除去混在乙炔中的少量乙烯 | |
| C. | 通过银镜反应可以区分甲醛和乙醛 | |
| D. |  用图所示实验装置制取交纯净的乙酸乙酯 |
6.短周期中元素a、b、c在周期表中位置如图所示,下列有关这三种元素的叙述中正确的是( )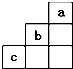

| A. | b的氢化物很稳定 | |
| B. | a是一种活泼的非金属元素 | |
| C. | c的最高价氧化物的水化物是一种弱酸 | |
| D. | b元素在化合物中的最高价为+7价 |
3.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 食盐水和糖水 | B. | 泥沙和水 | C. | 碘和四氯化碳 | D. | 水和四氯化碳 |
20.发展低成本、新型太阳能是解决未来社会能源问题的有效途径.目前,太阳能电池的发展已经进入了第三代,其常用材料除单晶硅,还有铜铟镓硒等化物质.完成下列填空:
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1或1s22s22p63s23p63d54s1.
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示)Br>As>Se.
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子之间还形成了π键.
(4)金属铜能形成多种配合物,如复合物氯化羰基亚铜[Cu2C12(CO)2•2H2O],其结构如图1.
①该配合物中Cl原子的杂化类型为sp3.
②该配合物中的配位体有3种.
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(6)单晶硅的结构与金刚石结构相似(如图2),若将金刚石晶体中一半的C原子换成Si原子,则得如图2所示的金刚砂(SiC)结构.在SiC中,每个C原子周围最近的C原子数目为12;若SiC晶体密度为ag.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$ cm (列式表示).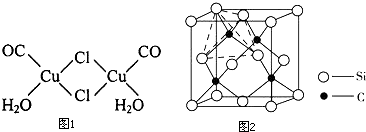
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1或1s22s22p63s23p63d54s1.
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示)Br>As>Se.
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子之间还形成了π键.
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
①该配合物中Cl原子的杂化类型为sp3.
②该配合物中的配位体有3种.
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(6)单晶硅的结构与金刚石结构相似(如图2),若将金刚石晶体中一半的C原子换成Si原子,则得如图2所示的金刚砂(SiC)结构.在SiC中,每个C原子周围最近的C原子数目为12;若SiC晶体密度为ag.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$ cm (列式表示).

1.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| D. | 将水加热,KW增大,pH不变 |