题目内容
20.发展低成本、新型太阳能是解决未来社会能源问题的有效途径.目前,太阳能电池的发展已经进入了第三代,其常用材料除单晶硅,还有铜铟镓硒等化物质.完成下列填空:(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1或1s22s22p63s23p63d54s1.
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示)Br>As>Se.
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子之间还形成了π键.
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
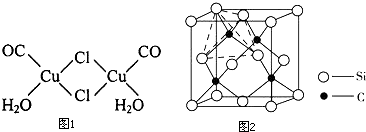
①该配合物中Cl原子的杂化类型为sp3.
②该配合物中的配位体有3种.
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(6)单晶硅的结构与金刚石结构相似(如图2),若将金刚石晶体中一半的C原子换成Si原子,则得如图2所示的金刚砂(SiC)结构.在SiC中,每个C原子周围最近的C原子数目为12;若SiC晶体密度为ag.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$ cm (列式表示).
分析 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,根据构造原理书写其基态原子核外电子排布式;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)三氟化硼分子中B原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型;硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成;
(4)①该配合物中,每个Cl原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论判断Cl原子杂化类型;
②该配合物的配体有Cl、CO、H2O;
(5)Cu、双氧水、一水合氨发生氧化还原反应生成铜氨络合离子、氢氧根离子和水;
(6)每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,据此判断每个C原子周围最近的C原子数目;
该晶胞中C原子个数是4,Si原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{a}$cm3,该晶胞边长=$\root{3}{\frac{4M}{a{N}_{A}}}$cm,晶胞体长=$\sqrt{3}$×$\root{3}{\frac{4M}{a{N}_{A}}}$cm,Si与C最近的距离为晶胞体长的$\frac{1}{4}$.
解答 解:(1)与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,位于周期表中d区,其基态原子的电子排布式为[Ar]3d54s1或1s22s22p63s23p63d54s1,故答案为:[Ar]3d54s1或1s22s22p63s23p63d54s1;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是Br>As>Se,
故答案为:Br>As>Se;
(3)三氟化硼分子中B原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,该微粒空间构型平面三角形;硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成,
故答案为:平面三角形;B与X原子之间还形成了π键;
(4)①该配合物中,每个Cl原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论知,Cl原子杂化类型为sp3,故答案为:sp3;
②该配合物的配体有Cl、CO、H2O,所以配体有3种,故答案为:3;
(5)Cu、双氧水、一水合氨发生氧化还原反应生成铜氨络合离子、氢氧根离子和水,离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O,
故答案为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(6)每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个C原子周围最近的C原子数目为3×4=12;
该晶胞中C原子个数是4,Si原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{a}$cm3,该晶胞边长=$\root{3}{\frac{4M}{a{N}_{A}}}$cm,晶胞体长=$\sqrt{3}$×$\root{3}{\frac{4M}{a{N}_{A}}}$cm,Si与C最近的距离为晶胞体长的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{4M}{a{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$cm,
故答案为:12;$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子核外电子排布、原子杂化方式判断、微粒空间构型判断等知识点,综合性较强,利用均摊法、构造原理、价层电子对互斥理论等知识点分析解答,难点是晶胞计算,注意C、Si原子最近距离与晶胞体长关系,题目难度中等.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | BaCl2溶液 | B. | 稀盐酸、BaCl2溶液 | ||
| C. | 稀硝酸、BaCl2溶液 | D. | 稀硫酸、BaCl2 |
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)元素③的原子结构示意图是
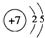 .
.(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是
 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3(填化学式).
(5)下列可以判断元素④和⑨非金属性强弱的是bc(填序号).
a.单质的熔点④比⑨低 b.单质与氢气反应④比⑨剧烈
c.气态氢化物稳定性④比⑨强 d.单质的密度④比⑨小
(6)元素⑥的单质和元素⑤的最高价氧化物对应的水化物的溶液反应,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| A. | 酸与碱的中和反应 | B. | 镁和盐酸的反应 | ||
| C. | 氧化钙和水反应 | D. | 水发生分解反应 |
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(NH4+)=c(C1-),c(OH-)=c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | D. | c(C1-)>c(NH4+),c(H+)>c(OH-) |
| A. | 672mL | B. | 336mL | C. | 大于672mL | D. | 小于336mL |
| A. | 同种元素的质子数必定相同 | |
| B. | 元素的化学性质主要决定于原子的最外层电子数 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | 元素性质呈现周期性变化的根本原因是核外电子排布呈周期性变化 |