题目内容
16.在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,加入的混合物质量与产生的气体体积(标准状况)之间的关系如图所示.请完成下列问题:(1)100mLNaOH溶液完全反应最多产生气体11.2L.
(2)求NaOH溶液的物质的量浓度.
(3)当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后生成的气体体积(标况)为多少升?
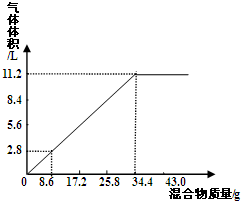
分析 (1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O,由图象可知,加入固体34.4g时生成氨气体积增大为11.2L;
(2)根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,然后结合反应方程式计算氢氧根的物质的量,再根据c=$\frac{n}{V}$计算氢氧化钠的物质的量浓度;
(3)当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为:$\frac{51.6g}{34.4g}$×100mL=150ml,而V(NaOH)=140 mL,说明固体过量,故n(NH3)=n(NaOH),据此计算解答.
解答 解:(1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O,从图中可看出加入34.4 g混合物时生成氨气的物质的量达到最大,则100mLNaOH溶液完全反应最多产生气体条件为11.2l,
故答案为:11.2L;
(2)由于100 mL NaOH恰好完全反应,则n(NaOH)=n(NH3)=$\frac{11.2L}{22.4L/mol}$=0.5 mol,
强氧化钠溶液的物质的量浓度为:c(NaOH)=$\frac{0.5mol}{0.1L}$=5mol/L,
答:NaOH溶液的物质的量浓度为5mol/L;
(3)当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为:$\frac{51.6g}{34.4g}$×100ml=150mL,而V(NaOH)=140 mL,说明固体过量,
所以产生氨气的物质的量为:n(NH3)=n(NaOH)=5 mol/L×0.14 L=0.7mol,V(NH3)=0.7mol×22.4 L/mol=15.68 L,
答:当NaOH溶液的体积为140mL,固体混合物质量是51.6g时,充分反应后生成的气体体积(标况)为15.68L.
点评 本题以图象形式考查混合物的有关计算,题目难度中等,注意明确发生反应的本质,利用离子方程式进行解答,综合考查学生分析解决问题的能力.

| A. | 乙醇 | B. | 1-丙醇 | C. | 丙酸 | D. | 丙三醇 |
| A. | CH3-CH=CH2和 | B. | 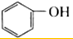 和 和 | ||
| C. | 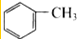 和 和 | D. | CH3-CH2-CH=CH2和CH2=CH-CH=CH2 |
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10 m | B. | 1.10×10-10 m | C. | 1.20×10-10 m | D. | 0.70×10-10 m |
| A. | ${\;}_{94}^{238}$Pu的原子核内中子数为144 | |
| B. | ${\;}_{94}^{238}$Pu的原子核内质子数为94 | |
| C. | ${\;}_{94}^{238}$Pu的原子核外电子数为144 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu的化学性质基本相同 |
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)元素③的原子结构示意图是
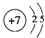 .
.(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是
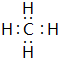 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3(填化学式).
(5)下列可以判断元素④和⑨非金属性强弱的是bc(填序号).
a.单质的熔点④比⑨低 b.单质与氢气反应④比⑨剧烈
c.气态氢化物稳定性④比⑨强 d.单质的密度④比⑨小
(6)元素⑥的单质和元素⑤的最高价氧化物对应的水化物的溶液反应,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(NH4+)=c(C1-),c(OH-)=c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | D. | c(C1-)>c(NH4+),c(H+)>c(OH-) |
| A. | SO2通入碘水中,反应的离子方程式为:SO2+I2+H2O═SO32-+2I-+2H+ | |
| B. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、A102- N03 - | |
| C. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |