��Ŀ����
14��X��Y��Z��W��Q��ԭ��������������Ķ���������Ԫ�أ����������ڱ��е����λ�������XԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ�Z�ǵؿ��к������Ľ���Ԫ��| X | Y | ||
| Z | W | Q |
 ��
����2��W�����������Ļ�ѧʽΪP2O5��Yԭ������ԭ�ӹ��ɵ����10�������ĵ���ʽΪ
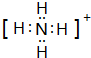 ��
����3��X������γɶ��ֻ�������ӣ�����һ�ַ��Ӻ�18�����ӣ������ʽΪC2H6��
��4������Y����̬�⻯��ף�
��д������Q������������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽ2NH3+H2SO4=��NH4��2SO4��
�������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2 �����������������Ӧ�IJ��ﲻ��Ⱦ�������仯ѧ����ʽΪ2NH3+3H2O2=N2+6H2O���÷�Ӧ����������H2O2������0.1mol�ײμӷ�Ӧʱ������ת��0.3 mol��
��5��Q��Y�γɵ�һ�ֶ�Ԫ���������ɫ��ЧӦ������Է���������170��190֮�䣬��Q����������ԼΪ69.6%����û�����ķ���ʽΪS4N4��
���� X��Y��Z��W��Q��ԭ��������������Ķ���������Ԫ�أ������������ڱ��е����λ�ã���֪X��Y���ڵڶ����ڣ�Z��W��Q���ڵ������ڣ�XԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ���XΪCԪ�أ�Z�ǵؿ��к������Ľ���Ԫ�أ���ZΪAl������֪YΪNԪ�ء�WΪPԪ�ء�QΪSԪ�أ�
��1������Ԫ��������=���Ӳ���������������=������������Z�����Ӻ�����10�����ӣ���2�����Ӳ㣬���������Ϊ2��8��
��2��W�����������Ϊ���������ף�Yԭ������ԭ�ӹ��ɵ����10������ΪNH4+��
��3��X������γɶ��ֻ�������ӣ�����һ�ַ��Ӻ�18�����ӣ�ֻ�ܺ���2��Cԭ�ӣ�Hԭ����ĿΪ6��
��4��Y����̬�⻯���ΪNH3��
��Q������������Ӧˮ����ΪH2SO4���백����Ӧ��������泥�
�ڰ�����ˮ��Һ������ʴ��H2O2 �����������������Ӧ�IJ��ﲻ��Ⱦ������Ӧ���ɵ�����ˮ������Ԫ�ػ��ϼ۽��͵ķ�Ӧ��Ϊ������������NԪ�ػ��ϼ۱仯����ת�Ƶ��ӣ�
��5�����������������㻯������N��Sԭ����Ŀ֮�ȣ������Է�������ȷ����ѧʽ��
��� �⣺X��Y��Z��W��Q��ԭ��������������Ķ���������Ԫ�أ������������ڱ��е����λ�ã���֪X��Y���ڵڶ����ڣ�Z��W��Q���ڵ������ڣ�XԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ���XΪCԪ�أ�Z�ǵؿ��к������Ľ���Ԫ�أ���ZΪAl������֪YΪNԪ�ء�WΪPԪ�ء�QΪSԪ�أ�
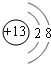
��1��QΪSԪ�أ��������ڱ��е������ڢ�A�壬Al3+���ӽṹʾ��ͼΪ ��
��
�ʴ�Ϊ���������ڢ�A�壻 ��
��
��2��W�����������ΪP2O5��Yԭ������ԭ�ӹ��ɵ����10������ΪNH4+������ʽΪ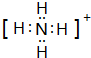 ���ʴ�Ϊ��P2O5��
���ʴ�Ϊ��P2O5��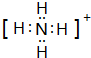 ��
��
��3��X������γɶ��ֻ�������ӣ�����һ�ַ��Ӻ�18�����ӣ�ֻ�ܺ���2��Cԭ�ӣ�Hԭ����ĿΪ6������ʽΪC2H6���ʴ�Ϊ��C2H6��
��4��Y����̬�⻯���ΪNH3��
��Q������������Ӧˮ����ΪH2SO4���백����Ӧ��������泥���Ӧ����ʽΪ��2NH3+H2SO4=��NH4��2SO4���ʴ�Ϊ��2NH3+H2SO4=��NH4��2SO4��
�ڰ�����ˮ��Һ������ʴ��H2O2 �����������������Ӧ�IJ��ﲻ��Ⱦ������Ӧ���ɵ�����ˮ����Ӧ����ʽΪ��2NH3+3H2O2=N2+6H2O��H2O2��OԪ�ػ��ϼ۽��ͣ�H2O2Ϊ����������Ӧ��NԪ�ػ��ϼ���-3������Ϊ0�ۣ�0.1mol�ײμӷ�Ӧʱ��ת�Ƶ���Ϊ0.3mol��
�ʴ�Ϊ��2NH3+3H2O2=N2+6H2O��H2O2��0.3��
��5��YΪNԪ�أ�QΪSԪ�أ��γɵĻ�������S����������Ϊ69.6%����S��Nԭ�Ӹ�����Ϊ$\frac{69.6%}{32}$��$\frac{1-69.6%}{14}$=1��1������Է���������170��190֮�䣬�軯ѧʽΪ��SN��x����170��46x��190�����x=4ʱ���ʶ����γɵķ���ʽΪS4N4���ʴ�Ϊ��S4N4��
���� ���⿼��Ԫ�����ڱ���Ԫ�������ɡ����û�ѧ����ȣ��Ѷ��еȣ�ע���Ԫ�������ɵ��������գ�

| A�� | �����ʵ���Ũ�ȵ�FeBr2��CuCl2�����Һ�ö��Ե缫������������Cu 2++2Br- $\frac{\underline{\;���\;}}{\;}$Cu+Br2 | |
| B�� | Na2S��Һˮ�⣺S2-+2H2O?H2S+2OH- | |
| C�� | Fe��NO3��3��������Һ��ͨ���������⣺2Fe3++H2S=2Fe2++S��+2H+ | |
| D�� | H218O��Ͷ��Na2O2��2H218O+2Na2O2=4Na++4OH-+18O2�� |
���������־����˵������ȷ���ǣ�������
| A�� | �����൪�����ЦҼ��ͦм�������Ӳ�ȴ� | |
| B�� | �����൪������������С�������ʵ��� | |
| C�� | ���־����еļ��м��Լ����зǼ��Լ� | |
| D�� | ���־����Ϊԭ�Ӿ��� |
| A�� | ��һС����Ͷ�뵽ʢ������ͭ��Һ���ձ��У�����û���Ϻ�ɫ��ͭ����������˵���ƵĽ����Ա�ͭ�� | |
| B�� | ��ʪ��ĵ��۵⻯����ֽ�����������������ĵ����϶ˣ�������ֽ������˵����Ԫ�صķǽ����Աȵ�Ԫ��ǿ | |
| C�� | ��H2S�����Cl2�ڼ���ƿ�л�ϣ�һ��ʱ�����ƿ���е���ɫ����������˵��Cl�ķǽ����Ա�Sǿ | |
| D�� | ��0.1 mol Na��Mg��Al�ֱ�������ϡ���ᷴӦ������ʧȥ�ĵ������ֱ�Ϊ0.1 mol��0.2 mol��0.3 mol��˵�������ֽ����Ļ�����Ϊ��Al��Mg��Na |
| A�� | ���γɻ�ѧ���ͷŵ��������ڶ��ѻ�ѧ�������յ����������Ƿ��ȷ�Ӧ | |
| B�� | ��ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol��������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��ų�����������57.3 kJ | |
| C�� | ��4P��s�����ף��TP4��s�����ף���H=+139.2 kJ/mol����֪���ױȰ����ȶ� | |
| D�� | ��101 kPaʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ ����������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ2H2��g��+O2��g���T2H2O��l����H=-285.8 kJ/mol |
��1���±���Ԫ�����ڱ���һ���֣����ݱ��и�����8��Ԫ�أ���Ԫ�ط��Ż�ѧʽ�ش��������⣺
| ������ | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | A | B | C | D | ||||
| 3 | E | F | G | H |
��Ԫ������������Ӧˮ�����У�������ǿ����HClO4��
��B��C��Ԫ�ص���̬�⻯����ȶ��Խ�ǿ���ǵ�������VA�壮
��2�����ֶ�����Ԫ�������ڱ��е����λ����ͼ��ʾ������ZԪ��ԭ�Ӻ��������������������������3����
| X | ||
| Y | Z | W |
��Ԫ��Zλ�����ڱ��е�������VA �壮
��YԪ�ص�ԭ�ӽṹʾ��ͼΪ
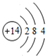 ��
����Ԫ��X����̬�⻯����Ԫ��W������������Ӧˮ���ﷴӦ���������л�ѧ�������������Ӽ������ۼ���
| A�� | 0.1 mol•L-1ij��Ԫ�������ʽ��NaHA��Һ�У�c��Na+��=2c��A2-��+c��HA-��+c��H2A�� | |
| B�� | ij��ʽ��NaHY��ˮ��Һ�Լ��ԣ�����ʽ����Һ������Ũ�ȹ�ϵΪ��c��Na+����c��HY-����c��OH-����c��H+�� | |
| C�� | ���ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ�c��CH3COO-��+c��OH-��=c��H+��+c��CH3COOH�� | |
| D�� | 25�棬pH=12�İ�ˮ��pH=2������������ϣ�c��Cl-����c��NH4+����c��H+����c��OH-�� |
| A�� | ԭ����ǰѵ���ת��Ϊ��ѧ�ܵ�װ�� | |
| B�� | ԭ����е���������һ���Ǹ�����������ԭ��Ӧ | |
| C�� | ����ԭ��ص��������������ֲ�ͬ�Ľ��� | |
| D�� | Cu-Feϡ����ԭ��ع���ʱ��ͭ������ |
| A�� | Cl2+H2O�THCl+HClO | B�� | 3Fe+4H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2 | ||
| C�� | 2F2+2H2O�T4HF+O2 | D�� | 3NO2+H2O�T2HNO3+NO |