题目内容
2.根据下列各反应现象所归纳的元素性质不正确的是( )| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出,不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol,说明这三种金属的活泼性为:Al>Mg>Na |
分析 A.钠性质很活泼,极易和水反应生成NaOH和氢气,NaOH和硫酸铜发生置换反应;
B.元素的非金属性越强,其单质的氧化性越强;
C.元素的非金属性越强,其单质的氧化性越强;
D.元素的金属性越强,元素单质与酸反应越容易生成氢气.
解答 解:A.钠性质很活泼,极易和水反应生成NaOH和氢气,NaOH和硫酸铜发生置换反应生成氢氧化铜和硫酸钠,将钠投入硫酸铜溶液中没有Cu生成,不能说明钠的金属性比Cu弱,故A正确;
B.元素的非金属性越强,其单质的氧化性越强,用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,则氯气能置换出碘,由此说明氯元素的非金属性比碘元素强,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,则氯气能置换出S,由此说明Cl的非金属性比S强,故C正确;
D.元素的金属性越强,元素单质与酸反应越容易生成氢气,与失电子多少无关,所以该实验不能说明这三种金属的活泼性强弱,故D错误;
故选D.
点评 本题考查金属性强弱判断,为高频考点,金属的金属性强弱与失电子难易程度有关,与失电子多少无关,为易错题.

练习册系列答案
相关题目
12.有关核电荷数为1~18的元素,下列叙述中正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素不一定是金属元素 | |
| D. | 核电荷数为17的元素的原子易获得1个电子 |
10.下列实验不能达到预期目的是( )
| 实验操作 | 实验目的 | |
| A | 向NaBr溶液中滴加新制氯水 | 比较Cl2与Br2的氧化性强弱 |
| B | 用同一电路分别测定盐酸和某一元酸溶液的导电性 | 比较盐酸和该一元酸酸性的强弱 |
| C | 分别向AlCl3溶液和MgCl2溶液中加入过量NaOH溶液 | 比较镁与铝的金属性强弱 |
| D | 常温下测定同浓度Na2CO3溶液和Na2SO4溶液的pH值 | 比较硫和碳的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
17.有a、b、c、d四种金属,将a与b用导线连结浸入某电解质溶液中,电流由b经外电路流向a.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是( )
| A. | d、a、b、c | B. | b、a、d、c | C. | d、b、a、c | D. | d、c、a、b |
14.X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,它们在周期表中的相对位置如表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素
(1)元素Q在周期表中的位置是第三周期ⅥA族,Z的离子结构示意图为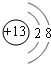 .
.
(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为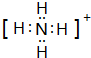 .
.
(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
| X | Y | ||
| Z | W | Q |
 .
.(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为
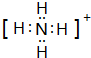 .
.(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
11.下面有关晶体的叙述中,不正确的是( )
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 金属钾的晶胞空间利用率大于金属钋的晶胞空间利用率 | |
| D. | 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构 |
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1mol Cl2和HCl的混合气体所含分子总数为2NA | |
| B. | 101kPa、0℃时,22.4 L H2中氢原子数为NA个 | |
| C. | 标准状况下,2.24 L CCl4含有的碳原子数目为0.1NA | |
| D. | 常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
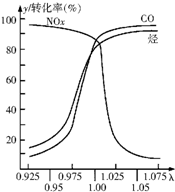 随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.
随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.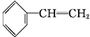 +Br2→
+Br2→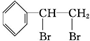 ,反应类型是加成反应.
,反应类型是加成反应. .
.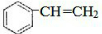 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$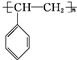 .
.