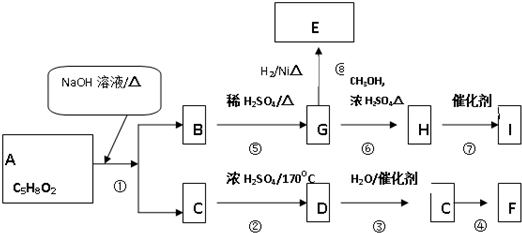
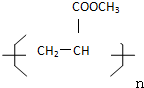题目内容
6.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A、溶液中的物料守恒分析,钠元素和A元素物质的量相同;
B、某酸式盐NaHY的水溶液显碱性,说明HY-水解大于电离;
C、依据溶液中物料守恒和电荷守恒计算分析判断;
D、pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性.
解答 解:A、溶液中的物料守恒分析,钠元素和A元素物质的量相同,c(Na+)=c(A2-)+c(HA-)+c(H2A),故A错误;
B、某酸式盐NaHY的水溶液显碱性,说明HY-水解大于电离,溶液中离子浓度大小为:c(Na+)>c(HY-)>c(OH-)>c(H+),故B正确;
C、物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C错误;
D、pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以得c(NH4+)>c(Cl-),溶液中一水合氨电离程度较小,所以c(Cl-)>c(OH-),则溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选B.
点评 本题考查酸碱溶液的混合、涉及电离、水解、酸碱混合的定性判断及电荷守恒、物料守恒的就应用,注重高考常考考点的考查,侧重反应原理的训练,题目难度中等.

练习册系列答案
相关题目
16.下列说法中,不正确的是( )
| A. | SO2(g)+0.5O2(g)?SO3(g)△H=-213kJ•mol-1 说明25℃,101kPa下,lmolSO2与0.5mol氧气放入密闭容器中生成SO3时放出213 kJ热量 | |
| B. | 若反应物总能量高于生成物总能量,反应放热,△H<0 | |
| C. | 化学反应必然伴随能量变化 | |
| D. | 酸和碱的中和反应都是放热反应 |
17.有a、b、c、d四种金属,将a与b用导线连结浸入某电解质溶液中,电流由b经外电路流向a.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是( )
| A. | d、a、b、c | B. | b、a、d、c | C. | d、b、a、c | D. | d、c、a、b |
14.X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,它们在周期表中的相对位置如表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素
(1)元素Q在周期表中的位置是第三周期ⅥA族,Z的离子结构示意图为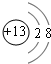 .
.
(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为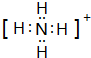 .
.
(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
| X | Y | ||
| Z | W | Q |
 .
.(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为
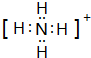 .
.(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
11.下面有关晶体的叙述中,不正确的是( )
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 金属钾的晶胞空间利用率大于金属钋的晶胞空间利用率 | |
| D. | 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构 |
18.生命起源于海洋,科学家认为,由于海洋中Al3+的浓度极低,所以Al元素未成为人体内的必需元素,相反它对人体有害,下列有关铝的说法中不正确的是( )
| A. | 家庭不宜用铝锅长期盛放菜,汤等食品 | |
| B. | 明矾[KAl(SO4)2•12H2O]含结晶水,是混合物 | |
| C. | Al既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | 铝热反应是放热反应 |
15.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若X原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )
| X | |||
| Y | Z | W |
| A. | 原子半径:Y>Z>X | |
| B. | 气态氢化物的稳定性:W>Z>X | |
| C. | 最高价氧化物对应水化物的酸性:W>Z>Y | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |