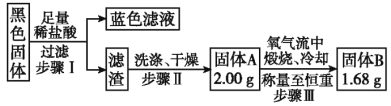
题目内容
【题目】向含有1 mol HNO3和1 mol NaHSO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是( )
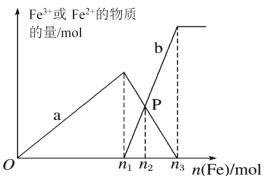
A.a表示Fe3+的关系曲线,b表示Fe2+的关系曲线
B.n1=0.5
C.P点时,n(Fe2+)=0.3mol
D.向P点溶液中加入铜粉,最多可溶解14.4g
【答案】BC
【解析】
向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,先是发生反应:Fe+4H++NO3-═Fe3++NO↑(气体)+2H2O,铁过量后是2Fe3++Fe=3Fe2+,n2点时候Fe3+和Fe2+的物质的量相同,据此分析计算。
A、向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,现实发生反应:Fe+4H++NO3-═Fe3++NO↑(气体)+2H2O,铁过量后是2Fe3++Fe=3Fe2+,a是表示Fe3+的关系曲线,b表示Fe2+的关系曲线,故A正确;
B、向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,先发生:Fe+4H++NO3-═Fe3++NO↑(气体)+2H2O,1molHNO3和1molH2SO4共有3moLH+,1mol的NO3-完全氧化需要4molH+,应该按照H+离子计算,产生Fe3+离子为![]() mol,即n1=0.75mol,故B错误;
mol,即n1=0.75mol,故B错误;
C、当铁过量,会有:2Fe3++Fe=3Fe2+,P点时Fe3+和Fe2+的物质的量相同,设Fe3+被还原xmol,
2Fe3++Fe=3Fe2+,
2 3
x 1.5x
有0.75-x=1.5x,x=0.3,此时Fe3+的为0.45,所以P点时,n(Fe2+)=0.45mol,故C错误;
D、向P点溶液中加Cu:2Fe3++Cu=2Fe2++Cu2+,设加入铜的质量是y,
2Fe3+ + Cu = 2Fe2++Cu2+
2mol 64g
0.45mol y
![]() =
=![]() ,解得y=14.4g,即最多可溶解14.4gCu粉,故D正确;
,解得y=14.4g,即最多可溶解14.4gCu粉,故D正确;
故选BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)对于反应2SO2(g)+ O2(g) 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减少”、“不变”)。
编号 | 改变的条件 | 生成SO3的反应速率 |
① | 升高温度 | ___________ |
② | 降低温度 | ___________ |
③ | 增大氧气的浓度 | ___________ |
④ | 使用催化剂 | ___________ |
⑤ | 压缩体积 | ___________ |
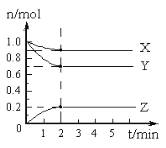
(2)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示。请回答下列问题。
①计算反应开始至2 min,Y的平均反应速率________。
②分析有关数据,写出X、Y、Z的反应方程式________。
③由图中看出:________分钟后,A、B、C各物质的物质的量不再随时间而变化,说明在这个条件下,该反应已达到了平衡状态。