题目内容
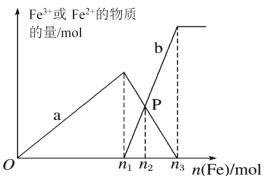
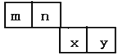
【题目】m、n、x、y四种主族元素在周期表里的相对位置如下图所示。已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的分子式为_____________ ,空间构型为_____________。
(2)m与y所形成的化合物含_________ 键,属_________ 分子。(填“极性”或“非极性”)
(3)x位于周期表中的位置是______;与其最高价含氧酸根离子互为等电子体的分子是_____________(写一种)。
(4)由n、y的氢化物相互作用所生成的物质在固态时属于_________晶体,y的某种含氧酸钠盐显碱性,其原因为_______________(用离子方程式表示)
【答案】NH3 三角锥形 极性 非极性 第三周期第VIA族 CCl4 离子 ClO- + H2O HClO + OH-
【解析】
m、n、x、y四种主族元素,它们的原子序数总和为46,由它们在周期表里的相对位置可以知道,x、y不可能处于第四周期,因为第四周期中两种主族元素的原子序数最小为19+20=39,m与n的原子序数之和小于(46-39),同理可得m、n不可能处于第三周期,故m、n处于第二周期,x、y处于第三周期,令m的原子序数为a,则n、x、y的原子序数分别为a+1、a+10、a+11,则a+a+1+a+10+a+11=46,计算得出a=6,故m为C元素、n为N元素、x为S元素、y为Cl元素。
(1)元素n的气态氢化物为NH3,NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形;
(2)m与y所形成的化合物CCl4,CCl4分子中含有4个C-Cl键,属于极性键,而CCl4分子中C原子采取sp3杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型,因而属于非极性分子;
(3)x为S元素,原子序数为16,位于第三周期VIA族,其最高价含氧酸根离子为SO42-, SO42-价层共有6+6×4+2=32个电子,含有5个原子,例如:CCl4含有5个原子,32个价电子,和SO42-互为等电子体,故答案可填CCl4;
(4)n、y的氢化物分别为NH3和HCl,NH3和HCl反应生成NH4Cl,其为铵盐,铵盐属于离子化合物,因而NH4Cl为离子晶体,y的某种含氧酸钠盐显碱性,说明该含氧酸盐阴离子为弱酸的酸根离子,可推知y的含氧酸为HClO,y的某种含氧酸钠盐为NaClO,ClO-水解显碱性,其水解方程式为ClO- + H2O HClO + OH-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】醇脱水是制备烯烃的常用方法,实验室制备环己烯的反应和实验装置如图所示.可能用到的有关数据如下:

相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f容器中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.回答下列问题:
(1)由环己醇制取环己烯的方程式_________________;
(2)装置b的冷凝水方向是________________(填“下进上出”或“上进下出”);
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___(选答案);
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称及反应类型为_____、____;
(5)在分离提纯中,使用到的仪器f名称是___________;
(6)合成过程中加入浓硫酸的作用是_________;
【题目】如表中物质间的转化能按如图所示通过一步反应进行的是( )
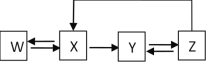
选项物质 | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D