��Ŀ����
����Ŀ��ij�о���ѧϰС���������ʵ��װ�ý���̽����
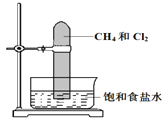
��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ____________��
��ʵ�����������֤��Ӧ���ɵ�������л�ԭ�ԣ�С��ͬѧȡװ��B����Һ������һ�ྻ���Թ��У�Ӧ���Թ��м�����Լ���___��������ĸ����
a��Ʒ����Һ b��ϡ���� c��BaCl2��Һ d��ϡ����
��ʵ�������С��ͬѧ����Ϩ��ƾ��ƣ����ܵ��µĺ����______________��
��ʵ�������������ͭƬ���渽�ź�ɫ���塣�������ϵ�֪�˺�ɫ������ܺ���CuO��CuS��Cu2S��������CuS��Cu2S��������ϡ���ᣬ�ڿ��������ն�ת��ΪCuO��SO2����С��ͬѧ�ռ�һ������ɫ���壬������ʵ�鷽��̽����ɷ֣�
�ٲ�����м��������Ƿ�ϴ�Ӹɾ���ʵ�鷽����_______________��
�ں�ɫ����ijɷ���_______________��
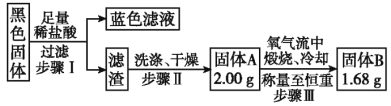
���𰸡�Cu+2H2SO4![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O ![]() װ��B�е���Һ�ᵹ��������������ƿ���� ȡ���һ��ϴ����Һ�������μ�����AgNO3��Һ������������ CuO��CuS��Cu2S
װ��B�е���Һ�ᵹ��������������ƿ���� ȡ���һ��ϴ����Һ�������μ�����AgNO3��Һ������������ CuO��CuS��Cu2S
��������
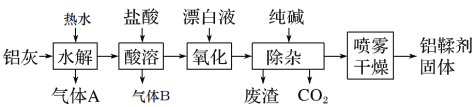
��1��ͭ��Ũ���Ṳ����������ͭ�����������ˮ��
��2����Bװ���й��������Ѷ�����������Ϊ���ᣬ��Ҫ�����������ԭ�ԣ�ʵ��Ҫ����������������Ĵ��ڣ�
��3����������������ˮ��Ҫ��������
��4����������ϴ�Ӹɾ����ʵ���Ǽ������������Ƿ����������ӣ���ʵ��������������ܻ��������ӣ�������Һ��ɫ�ı仯�����պ���������ı仯�жϺ�ɫ����ijɷ֡�
��1��ͭ��Ũ���Ṳ����������ͭ�����������ˮ����Ӧ����ʽΪ��Cu+2H2SO4![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
��2����Bװ���й��������Ѷ�����������Ϊ���ᣬ��Ҫ�����������ԭ�ԣ�ʵ��Ҫ����������������Ĵ��ڣ�����ϡ������Ȼ��������飬
�ʴ�Ϊ��bc��
��3�����ڶ�������������ˮ��������Ϩ��ƾ��ƣ����ܵ��µĺ���Dz�����������
�ʴ�Ϊ��װ��B�е���Һ�ᵹ��������������ƿ���ѣ�
��4����������ϴ�Ӹɾ����ʵ���Ǽ������������Ƿ����������ӣ����ڹ����������ܽ⣬����������������ܻ��������ӣ����������������飮
�ʴ�Ϊ��ȡ���һ��ϴ����Һ�������μ�������������Һ������������
�����������ܽ����Һ������֤�������к�����ͭ������AΪͭ�����BΪCu2O��
��BȫΪCu2S��2Cu2S+3O2![]() 2Cu2O+2SO2
2Cu2O+2SO2
320 288
2g m1
���m1=1.8
��BȫΪCuS��4CuS+5O2![]() 2Cu2O+4SO2
2Cu2O+4SO2
384 288
2g m2
���m2=1.5g
��ʵ�ʵù���BΪ1.68g������m1��m2֮�䣬���Թ���AΪCu2S��CuS�Ļ���
�ʴ�Ϊ��CuO��CuS��Cu2S��

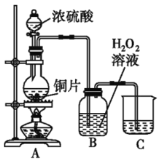
����Ŀ������ˮ���Ʊ�ϩ���ij��÷�����ʵ�����Ʊ�����ϩ�ķ�Ӧ��ʵ��װ����ͼ��ʾ�������õ����й��������£�

��Է������� | �ܶ�/��gcm��3�� | �е�/�� | �ܽ��� | |
���Ҵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣮb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森��Ӧ�ֲ��ﵹ��f�����зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ���ش��������⣺
��1���ɻ�������ȡ����ϩ�ķ���ʽ_________________��
��2��װ��b������ˮ������________________�������½��ϳ��������Ͻ��³�������
��3���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������___��ѡ�𰸣���
A���������� B����ȴ�� C�����貹�� D����������
��4����ʵ���������ײ����ĸ����������Ĺ��������Ƽ���Ӧ����Ϊ_____��____��
��5���ڷ����ᴿ�У�ʹ�õ�������f������___________��
��6���ϳɹ����м���Ũ�����������_________��
����Ŀ����������ʼ��ת���ܰ���ͼ��ʾͨ��һ����Ӧ���е��ǣ� ��
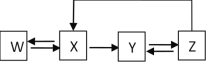
ѡ������ | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D