题目内容
常温下,下列溶液中可能大量共存的离子组是( )
| A、水电离产生的c(H+)=1×10-12mol/L的溶液中:AlO2-、S2-、PO43-、Na+ |
| B、加入金属镁能产生H2的溶液中:Na+、HCO3-、SO42-、Al3+ |
| C、能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32-、CO32- |
| D、含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.水电离产生的c(H+)=1×10-12mol/L的溶液中为酸性或者碱性溶液,碱性溶液中AlO2-、S2-、PO43-、Na+之间不反应,可以大量共存;
B.加入金属镁能产生H2的溶液为酸性溶液,碳酸氢根离子能够与氢离子反应,在溶液中一定不能大量共存;
C.能使Al溶解产生H2的溶液为酸性或者碱性溶液,铵根离子能够与碱溶液反应,硅酸根离子、碳酸根离子能够与酸溶液反应;
D.次氯酸根离子具有氧化性,亚铁离子具有还原性,二者能够发生氧化还原反应.
B.加入金属镁能产生H2的溶液为酸性溶液,碳酸氢根离子能够与氢离子反应,在溶液中一定不能大量共存;
C.能使Al溶解产生H2的溶液为酸性或者碱性溶液,铵根离子能够与碱溶液反应,硅酸根离子、碳酸根离子能够与酸溶液反应;
D.次氯酸根离子具有氧化性,亚铁离子具有还原性,二者能够发生氧化还原反应.
解答:
解:A.水电离产生的c(H+)=1×10-12mol/L的溶液可能为酸性或者碱性溶液,AlO2-、S2-、PO43-、Na+离子之间不发生反应,碱性溶液中,都不与OH-离子反应,在碱性溶液中能够大量共存,故A正确;
B.加入金属镁能产生H2的溶液中存在大量的H+离子,HCO3-能够与H+反应生成二氧化碳气体,在溶液中一定不能大量共存,故B错误;
C.能使Al溶解产生H2的溶液中存在大量的H+离子或者OH-离子,SiO32-、CO32-能够与H+反应,NH4+与OH-反应,在溶液中一定不能大量共存,故C错误;
D.Fe2+、ClO-之间能够发生氧化还原反应,在溶液中一定不能大量共存,故D错误;
故选A.
B.加入金属镁能产生H2的溶液中存在大量的H+离子,HCO3-能够与H+反应生成二氧化碳气体,在溶液中一定不能大量共存,故B错误;
C.能使Al溶解产生H2的溶液中存在大量的H+离子或者OH-离子,SiO32-、CO32-能够与H+反应,NH4+与OH-反应,在溶液中一定不能大量共存,故C错误;
D.Fe2+、ClO-之间能够发生氧化还原反应,在溶液中一定不能大量共存,故D错误;
故选A.
点评:本题考查了离子共存的判断,题目难度中等,注意掌握 离子反应发生条件,明确离子共存判断常用的方法,如:生成难溶物、弱电解质、气体的离子之间不能共存,发生氧化还原反应的离子之间不能共存等,本题中注意题干要求:“可能大量共存”.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在100mL某混合酸中,c(HNO3)=0.4mol?L-1,c(H2SO4)=0.1mol?L-1,向其中加入1.92g铜粉,待充分反应后,忽略溶液体积的变化,溶液中Cu2+的物质的量浓度为( )
| A、0.15 mol?L-1 |
| B、0.30 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
下列叙述正确的是( )
| A、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B、铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C、FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D、在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
下列说法正确的是( )
| A、食品保鲜膜成分为聚氯乙烯 |
| B、甲醛可作为海产品的防腐剂 |
| C、盐析可提纯蛋白质并保持其生理活性 |
| D、医疗上用于消毒的酒精其体积分数为95% |
下列物质中既含有离子键又含有共价键的化合物是( )
| A、NaCl |
| B、CH4 |
| C、KOH |
| D、CH3Cl |
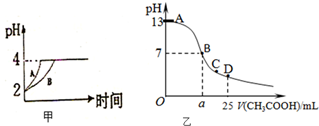 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: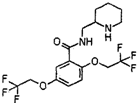 ,它可由龙胆酸(
,它可由龙胆酸(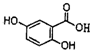 ,为原料合成,合成的方法如图:
,为原料合成,合成的方法如图: