题目内容
16.胆矾(CuSO4•5H2O)是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程图.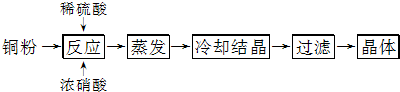
请回答下列各题:
(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象是溶液呈蓝色、有红棕色气体生成.
(2)制得的胆矾晶体(CuSO4•5H2O)中可能存在的杂质是Cu(NO3)2(填化学式).
(3)采用重量法测定CuSO4•5H2O的含量时,步骤如下:①取样,称量;②加水溶解;③加氯化钡溶液生成沉淀;④过滤(其余步骤省略).在过滤前,需要检验是否沉淀完全,其操作是向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全.
(4)某研究性学习小组用ZRY-1型热重分析仪对12.5g硫酸铜晶体(CuSO4•5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应.
a.CuSO4•5H2O$\frac{\underline{\;258℃\;}}{\;}$CuSO4+5H2O
b.CuSO4$\frac{\underline{\;650℃\;}}{\;}$CuO+SO3↑,2SO3$\stackrel{△}{?}$2SO2+O2
c.4CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑
实验过程中热重分析仪测得残留固体质量为3.8g,试推断该固体的组分是CuO与Cu2O(填化学式),其对应的物质的量之比是2:1.
分析 (1)铜与浓硝酸反应有硝酸铜和红棕色的二氧化氮产生,根据反应的产物判断现象;
(2)制硫酸铜时,用铜与硝酸、硫酸的混合物反应的,所以可根据反应物判断可能存在的杂质;
(3)需要检验是否沉淀完全,可以通过检验溶液中是否有硫酸根离子判断,可以向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(4)根据题中反应的方程式可知,最后残留的固体应为氧化铜或氧化亚铜或两者的混合物,根据铜元素守恒列方程组可求得混合的组成及物质的量之比.
解答 解:(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,观察到溶液呈蓝色、有红棕色气体生成,
故答案为:溶液呈蓝色;有红棕色气体生成;
(2)制硫酸铜时,用铜与硝酸、硫酸的混合物反应的,铜与硝酸能生成硝酸铜,所以可能混有硝酸铜杂质,化学式为Cu(NO3)2,
故答案为:Cu(NO3)2;
(3)需要检验是否沉淀完全,可以通过检验溶液中是否有硫酸根离子判断,可以向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全,
故答案为:向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(4)根据题中反应的方程式可知,最后残留的固体应为氧化铜或氧化亚铜或两者的混合物,设氧化铜的物质的量为xmol,氧化亚铜的物质的量为ymol,根据题意$\left\{\begin{array}{l}{(x+2y)×250=12.5}\\{80x+144y=3.8}\end{array}\right.$,解得x=$\frac{1}{40}$,y=$\frac{1}{80}$,所以CuO与Cu2O的物质的量之比为2:1,
故答案为:CuO与Cu2O;2:1.
点评 本题考查了物质含量的测定、实验现象等观察、实验原理的分析等,题目难度中等,侧重于考查学生的实验探究能力和计算能力.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | CuSO4溶液与铁粉反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 实验室制二氧化碳:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| C. | 二氧化碳与水反应:CO2+H2O═CO32-+2H+ | |
| D. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备氯化铜固体.

①仪器z的名称是分液漏斗.
②检验装置A气密性的操作为:关闭活塞,向分液漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气.
③实验过程中按照气流方向仪器接口连接顺序a→hidebc(cb)f,实验中D装置的作用是防止空气中水蒸气进入B,同时吸收多余的Cl2,防止空气污染.
(2)某研究小组模拟工业用粗铜(含杂质Fe)按下述流程制备无水CuCl2.

已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
②加试剂Y用于调节pH以除去杂质,则应调节pH范围是3.7≤pH<4.4,试剂Y可选用下列中的cd(填序号).
a.NaOH b.盐酸 c.CuO d.Cu2(OH)2CO3
③由溶液B制备无水CuCl2过程中的操作有:a.冷却结晶;b.过滤洗涤;c.蒸发浓缩;d.在干燥HCl气流中加热.则其操作顺序为cabd(填写序号).
| A. | 原子半径A>B>D>C | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 原子结构的最外层电子数目A>B>D>C |


 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题: