题目内容
14.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,回答下列问题.(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出28.65 kJ的热量.
(2)用2molH2SO4配稀溶液跟足量稀NaOH反应,此反应的中和热为57.3kJ/mol
(3)如果将(1)中和反应中稀盐酸换成稀醋酸时,反应放出的热量小于(1)放出的热量(填大于、小于、等于)
分析 根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量即可;中和热为固定值为57.3kJ/mol;弱酸电离吸热生成1mol水放出的热量小于57.3kJ/mol.
解答 解:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,
(1)20gNaOH即0.5mol氢氧化钠配成稀溶液后,氢氧根离子的浓度是0.5mol,和足量的酸之间反应会生成0.5mol水,所以放出热量为0.5×57.3kJ=28.65kJ,
故答案为:28.65;
(2)用2molH2SO4配稀溶液跟足量稀NaOH反应,此反应的中和热为57.3kJ/mol;
故答案为:57.3kJ/mol;
(3)弱酸电离吸热生成1mol水放出的热量小于57.3kJ/mol,所以如果将(1)中和反应中稀盐酸换成稀醋酸时,反应放出的热量小于(1)放出的热量;
故答案为:小于.
点评 本题考查了热化学方程式、中和热,反应热和方程式的系数成正比,根据中和反应的H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1的含义来计算即可,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
5.下列关于84消毒剂(主要成分是NaClO)的使用和保存不正确的是( )
| A. | 将消毒液放在阴凉、避光的地方 | |
| B. | 84消毒剂也可用于漂白 | |
| C. | 在使用时,要适当稀释,消毒液不是越浓越好 | |
| D. | 可与洁厕剂(含有盐酸)混合使用 |
2.胶体与其他分散系的本质区别是( )
| A. | 是否具有丁达尔现象 | B. | 是否均一 | ||
| C. | 是否透明 | D. | 分散质粒子直径大小 |
9.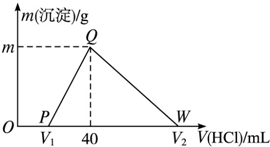 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金质量为0.92g | B. | 图中V2为60 | ||
| C. | 沉淀的质量m为1.56g | D. | OP段发生的反应为:OH-+H+═H2O |