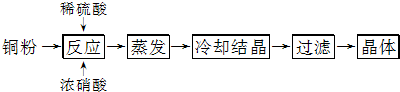
题目内容
5.分子式为C2H6O的化合物M具有如下性质:①M+Na-→慢慢产生气泡
②M+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$有香味的产物
(1)根据上述信息,对该化合物可作出的判断是AC.
A.一定含有-OH B.一定含有-COOH
C.M为乙醇 D.M为乙酸
(2)化合物M和CH3COOH反应生成的有香味的产物的名称为乙酸乙酯.
(3)写出反应的化学反应方程式
①2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
②CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O该反应属于取代反应.(选填:加成、氧化、取代)
分析 (1)化学式为C2H6O可能为醇类或者醚类,根据A能够与钠反应、能够发生酯化反应可知A为乙醇,含有官能团羟基;
(2)乙酸与乙醇在浓硫酸作用下发生反应生成乙酸乙酯;
(3)①乙醇与钠反应生成乙醇钠和氢气;
②乙酸与乙醇在浓硫酸作用下发生反应生成乙酸乙酯.
解答 解:(1)M的化学式为C2H6O,M可能为乙醇或者甲醚,根据题干中M能够与金属钠反应、能够与乙酸发生酯化反应可知,M只能为乙醇,含有的官能团为羟基,
故答案为:AC;
(2)乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,故答案为:乙酸乙酯;
(3)①乙醇与钠反应生成乙醇钠和氢气,该反应为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
②乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,该反应为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,酯化反应属于取代反应,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;取代.
点评 本题考查有机物的结构与性质,为高考高频考点,把握结构中官能团与性质的关系为解答的关键,侧重醇的推断及性质的考查,题目难度不大.

练习册系列答案
相关题目
17. 已知NH3是能用来做喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集NH3和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系式(不考虑烧瓶内溶质的扩散,氯水的溶质按NH3计算)( )
已知NH3是能用来做喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集NH3和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系式(不考虑烧瓶内溶质的扩散,氯水的溶质按NH3计算)( )
 已知NH3是能用来做喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集NH3和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系式(不考虑烧瓶内溶质的扩散,氯水的溶质按NH3计算)( )
已知NH3是能用来做喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集NH3和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系式(不考虑烧瓶内溶质的扩散,氯水的溶质按NH3计算)( )| A. | 溶质的物质的量浓度相同,溶质的质量分数不同 | |
| B. | 溶质的质量分数相同,溶质的物质的量不同 | |
| C. | 溶质的物质的量浓度和溶质的质量分数都不同 | |
| D. | 溶质的物质的量浓度和溶质的质量分数都相同 |
14.常温下,将Na2CO3溶液、Na2SO3和NaHCO3三种溶液混合,所得混合溶液中下列关系一定成立的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)>c(SO32-)>c(HSO3-) | |
| B. | c(Na+)>c(HCO3-)>c(CO32-)>c(SO32-)>c(OH-)>c(H+) | |
| C. | c(Na+)>[c(HCO3-)+c(CO32-)+c(H2CO3)+c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(HSO3-)+c(SO32-) |