题目内容
【题目】向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,加入氢氧化钡溶液的体积和所得沉淀的物质的量的关系如图所示。
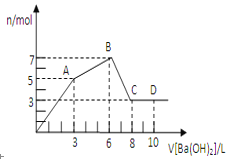
(1)氢氧化钡溶液浓度为_____________________。
(2)原混合溶液中SO42-和Cl-的物质的量之比为________。
【答案】1mol/L 1:2
【解析】
向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,反应的实质是铝离子与氢氧根离子、钡离子与硫酸根离子反应,结合方程式和图像分析解答。
(1)向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,反应的离子方程式有Ba2++SO42-=BaSO4↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O。假设1mol硫酸铝中硫酸根完全被沉淀需要氢氧化钡是3mol,3mol氢氧化钡提供6mol氢氧根,1mol硫酸铝中含有2mol铝离子,二者恰好沉淀生成氢氧化铝。从起点到A点可以认为是硫酸铝与氢氧化钡反应生成3mol硫酸钡和2mol氢氧化铝。A到B是氯化铝和氢氧化钡反应,B点时溶液中铝离子完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2;B到C是氢氧化铝溶解在氢氧化钡中,C点时氢氧化铝完全溶解。根据图像可知溶解氢氧化铝消耗氢氧化钡8L-6L=2L,消耗氢氧化铝是7mol-3mol=4mol,所以需要氢氧化钡是2mol,则氢氧化钡溶液浓度为2mol÷2L=1mol/L;
(2)根据图像可知硫酸钡是3mol,所以硫酸铝是1mol,氯化铝产生的氢氧化铝是2mol,因此氯化铝是2mol,所以原混合溶液中SO42-和Cl-的物质的量之比为3mol:6mol=1:2。

练习册系列答案
相关题目