题目内容
【题目】根据乙烯氧化成乙醛的反应,可设计成如图所示的电化学装置,下列说法不正确的是
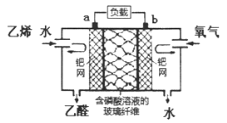
A.该电化学装置是原电池装置
B.电子移动方向:电极a→负载→电极b→磷酸溶液→电极a
C.a极反应式可表示为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D.当b极消耗标准状况下氧气5.6L时,理论上玻璃纤维中有NA个H+从左往右移动
【答案】B
【解析】
A、该电化学装置是将化学能转化为电能,所以该电化学装置是原电池,选项A正确;
B、电子经过外电路,不经过溶液,选项B不正确;
C、负极是乙烯发生氧化反应,所以a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+,选项C正确;
D、正极发生还原反应,所以氧气在b极被还原,电极反应为O2+ 4H++4e-=2H2O,则当b极消耗标准状况下氧气5.6L,即0.25mol氧气时,理论上玻璃纤维中有NA个H+从左往右移动,选项D正确;
答案选B。

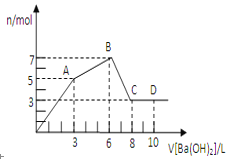
【题目】在汽车上安装高效催化转化器,可发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 甲 | 乙 | |||||||||||
0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | ||
c(NO)(×10-4mol/L) | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
c(CO)(×10-3mol/L) | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 | |
下列说法正确的是:
A.通过甲乙组数据对比可知,催化剂可以让原来不能自发进行的反应体系自发进行
B.根据化学反应原理综合分析可知:反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) 的△H<0
N2(g)+2CO2(g) 的△H<0
C.乙容器中,0~
D.达到平衡后,将容器乙中各物质的浓度均加倍,则体系K值增加,平衡正向移动