جâؤ؟ؤعبف
،¾جâؤ؟،؟¹رُ»¯ؤٍثط[CO(NH2)2،¤H2O2]تاز»ضضئ¯°×،¢دû¶¾،¢شِرُ¼ء£¬³£خآدآخھ°×ة«¾§جه£¬ز×سعضüشث£¬ز»°مجُ¼دآ²»ز×·ض½â£¬؟ةسأ30%µؤث«رُث®؛ح±¥؛حؤٍثطبـز؛شعز»¶¨جُ¼دآہ´؛د³ة،£
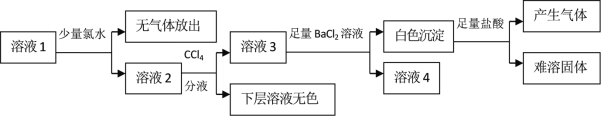
تµرéشہي£؛CO(NH2)2£«H2O2![]() CO(NH2)2،¤H2O2
CO(NH2)2،¤H2O2
تµرé×°ضأ£؛تµرéتزؤ£ؤâضئب،×°ضأبçح¼1ثùت¾(²؟·ضزائ÷خ´»³ِ)،£

تµرé²½ضè£؛
²½ضèز»£؛شع250mLµؤزائ÷aضذ¼سبë100mL30%µؤ¹رُ»¯اâبـز؛£¬شظ¼س1 g NaH2PO4×÷خب¶¨¼ء£¬؟ھئô½ء°èئ÷£¬ح¨¹زائ÷aسز¶ثئ؟؟ع»؛آ¼سبë50 gؤٍثط£¬ب«²؟بـ½â؛َ£¬؟طضئخآ¶بشع30،و×َسز£¬½ء°è·´س¦30·ضضس،£
²½ض趣؛½«زائ÷aضذµؤبـز؛سأئصح¨آ©¶·¹آث£¬½«آثز؛ہنب´µ½0،و£¬خِ³ِ´َء؟¾§جه£¬³éآث£¬؛و¸ة¼´µأ²ْئ·،£
»ط´ًدآءذختجâ£؛
(1)زائ÷a µؤأû³ئتا____________£¬ضئب،¹³جضذذè؟طضئn(H2O2):n[CO(NH2)2] =1.2 :1×َسز£¬²¢؟طضئ؛د³ةخآ¶بشع30،و×َسز£¬ئنض÷زھشزٍتا__________________________________£¬؟طضئ·´س¦خآ¶بµؤ¼سبب·½·¨تا________________،£
(2)تµرéتزز»°مسأ²£ء§¶ّ·اجْضت½ء°èئ÷µؤشزٍتا____________________________________،£¶ّتµ¼تةْ²ْضذ½ء°èئ÷ر،سأµؤتاجْضت²ؤءد£¬µ«ذ轫½ء°è×°ضأ·إشع__________________(جîتش¼ءأû³ئ)ضذ½إفز»¶خت±¼ن£¬ت¹ئن±يأو¶غ»¯،£
(3)¢ظ²½ضè¶ضذ،°³éآث،±°´ح¼2°²×°؛أ×°ضأ£¬شع²¼تدآ©¶·ضذ·إبëآثض½£¬½سدآہ´µؤ²ظ×÷ث³ذٍتا____________________،ْب·بد³é¸ة(جî±ê؛إ)
a. ×ھزئ¹جز؛»ى؛دخï b. ؟ھ´َث®ءْح· c. خ¢؟ھث®ءْح· d. ¼سبëةظء؟صôءَث®بَتھآثض½
¢عسëسأئصح¨آ©¶·¹آثدà±ب£¬³éآثµؤض÷زھسإµمتا______________________________،£
(4)¹رُ»¯ؤٍثط¼ّ¶¨·´س¦£؛شعضط¸ُثل¼طثلذشبـز؛ضذ¼سبëززأر؛حةظذي¹رُ»¯ؤٍثط£¬صٌµ´،£ةد²مززأر³تہ¶ة«£¬صâتاسةسعشعثلذشبـز؛ضذ¹رُ»¯ؤٍثطضذµؤ¹رُ»¯اâسëضط¸ُثل¼ط·´س¦ةْ³ة½دخب¶¨µؤہ¶ة«¹رُ»¯¸ُ(CrO5£؛![]() )£¬ضط¸ُثل¼طسëH2O2·´س¦µؤہë×س·½³جت½خھ_______________،£
)£¬ضط¸ُثل¼طسëH2O2·´س¦µؤہë×س·½³جت½خھ_______________،£
(5)¹رُ»¯ؤٍثطµؤ؛د¸ٌ²ْئ·ضذH2O2 µؤضتء؟·ضتس¦²»µحسع34%،£خھءثب·¶¨ؤ³´ختµرé²ْئ·؛د¸ٌسë·ٌ£¬³ئب،ءث¸أ´خرùئ·12.0000g£¬بـسعث®إنضئ³ة250mLبـز؛،£زئب،25.00mLبـز؛سع׶ذخئ؟ضذ£¬¼سبë1mL 6mol£¯Lµؤءٍثل£¬ب»؛َسأ0.2000 mol£¯L KMnO4±ê×¼بـز؛µخ¶¨£¬ب´خµخ¶¨ئ½¾ùدû؛ؤKMnO4بـز؛20.00mL(KMnO4بـز؛سëؤٍثط²»·´س¦)،£ضصµمرصة«±ن»¯خھ_____________،£¸ù¾فµخ¶¨½ل¹ûح¨¹¼ئثمإذ¶د¸أ´ختµرé²ْئ·ضتء؟خھ___________(جî،°؛د¸ٌ،±»ٍ،°²»؛د¸ٌ،±)،£
،¾´ً°¸،؟ب¾±ةصئ؟ H2O2شعتµرé¹³جضذ»لسذ²؟·ض·ض½â£¬شِ´َH2O2µؤء؟؟ةجل¸ك²ْئ·µؤ´؟¶ب ث®ش،¼سبب H2O2µؤث®بـز؛سëجْ·´س¦ةْ³ةFe3£«£¬؟ة´ك»¯¼س؟ىH2O2·ض½â إ¨ءٍثل(»ٍإ¨دُثل) d،ْc،ْa،ْb ¹آثثظ¶ب¸ü؟ى 4H2O2£«Cr2O![]() £«2H£«===2CrO5£«5H2O خقة«±نا³؛ىة« ²»؛د¸ٌ
£«2H£«===2CrO5£«5H2O خقة«±نا³؛ىة« ²»؛د¸ٌ
،¾½âخِ،؟
ث«رُث®،¢ؤٍثط،¢خب¶¨¼ءشع·´س¦ئ÷ضذ»ى؛د·¢ةْ·´س¦µأµ½¹رُ»¯ؤٍثط´ض²ْئ·£¬ب»؛َح¨¹صô·¢إ¨ثُ،¢ہنب´½ل¾§،¢¹آثµأµ½¾§جه؛حؤ¸ز؛£¬½«¾§جهد´µس،¢¸ةشïµأµ½²ْئ·£»
(1)زائ÷aµؤأû³ئتاب¾±ةصئ؟£»ث«رُث®؛ح¹رُ»¯ؤٍثطشعخآ¶ب¸كت±ز×·ض½â£»ہûسأث®ش،¼سبب؟ةزش؟طضئ·´س¦خآ¶ب£»
(2)ث«رُث®؛حجْ·´س¦ةْ³ةجْہë×س£¬جْہë×سؤـ×÷ث«رُث®·ض½âµؤ´ك»¯¼ء£»جْسِإ¨ءٍثل»ٍإ¨دُثل¶غ»¯£»
(3)¸ù¾ف³éآثµؤ²ظ×÷²½ضè½ّذذر،شٌ£»
(4)¸ù¾فجâؤ؟ضذثù¸ّذإد¢ذ´³ِہë×س·½³جت½£»
(5)زہ¾ف2MnO4£«5H2O2£«6H£«£½2Mn2£«£«8H2O£«5O2¼ئثم¹رُ»¯اâخïضتµؤء؟£¬½ّ¶ّ¼ئثم³ِ¹رُ»¯اâµؤضتء؟·ضت،£
ث«رُث®،¢ؤٍثط،¢خب¶¨¼ءشع·´س¦ئ÷ضذ»ى؛د·¢ةْ·´س¦µأµ½¹رُ»¯ؤٍثط´ض²ْئ·£¬ب»؛َح¨¹صô·¢إ¨ثُ،¢ہنب´½ل¾§،¢¹آثµأµ½¾§جه؛حؤ¸ز؛£¬½«¾§جهد´µس،¢¸ةشïµأµ½²ْئ·£»
(1)زائ÷aµؤأû³ئتاب¾±ةصئ؟£»ضئب،¹³جضذذè؟طضئn(H2O2):n[CO(NH2)2] =1.2£؛1×َسز£¬شزٍتاH2O2شعتµرé¹³جضذ»لسذ²؟·ض·ض½â£¬شِ´َH2O2µؤء؟؟ةجل¸ك²ْئ·µؤ´؟¶ب£»ہûسأث®ش،¼سبب؟ةزش؟طضئ·´س¦خآ¶ب£»
(2)ث«رُث®؛حجْ·´س¦ةْ³ةجْہë×س£¬جْہë×سؤـ×÷ث«رُث®·ض½âµؤ´ك»¯¼ء£¬خھ·ہض¹ث«رُث®·ض½â£¬ثùزش²»ؤـسأFeضئبفئ÷£»جْسِإ¨ءٍثل»ٍإ¨دُثل¶غ»¯£¬¹تذ轫½ء°è×°ضأ·إشعإ¨ءٍثل»ٍإ¨دُثلضذ½إفز»¶خت±¼ن£»
(3)¢ظ¸ù¾ف³éآثµؤ²ظ×÷²½ضè؟ةضھ£¬شع²¼تدآ©¶·ضذ·إبëآثض½؛َ£¬¼سبëةظء؟صôءَث®بَتھآثض½£¬خ¢؟ھث®ءْح·£¬×ھزئ¹جز؛»ى؛دخï؛َ£¬؟ھ´َث®ءْح·£¬ب·بد³é¸ة£¬ثùزش²ظ×÷إإذٍ£؛d،ْc،ْa،ْb£»
¢عسëسأئصح¨آ©¶·¹آثدà±ب£¬³éآثµؤض÷زھسإµمتا¹آثثظ¶ب¸ü؟ى£»
(4)شعثلذشبـز؛ضذ¹رُ»¯ؤٍثطضذµؤ¹رُ»¯اâسëضط¸ُثل¼ط·´س¦ةْ³ة½دخب¶¨µؤہ¶ة«¹رُ»¯¸ُCrO5£¬ہë×س·½³جت½خھ£؛4H2O2£«Cr2O72-£«2H£«=2CrO5£«5H2O£»
(5)³ئب،¸ةشïرùئ·12.000g£¬بـ½â£¬شع250mLبفء؟ئ؟ضذ¶¨بف,×¼ب·ء؟ب،25.00mLسع׶ذخئ؟ضذ£¬¼سبë1mL 6mol/Lµؤءٍثل£¬ب»؛َسأ0.2000mol/L KMnO4±ê×¼بـز؛µخ¶¨£¬¸كأجثل¸ùہë×س±»»¹شخھخقة«µؤأجہë×س£¬µ±¸كأجثل¼طبـز؛µخبë×î؛َز»µخت±£¬بـز؛خقة«±نا³؛ىة«از°ë·ضضسؤع²»حتة«£¬´ïµ½µخ¶¨ضصµم£»ب´خµخ¶¨ئ½¾ùدû؛ؤKMnO4بـز؛20.00mL£»زہ¾ف·´س¦2MnO4£«5H2O2£«6H£«£½2Mn2£«£«8H2O£«5O2£»

250mLبفء؟ئ؟ضذ؛¬¹رُ»¯اâ0.1mol£»¹رُ»¯اâضتء؟·ضت£½![]() ،ء100%£½28.3%<34%£¬¹ت¸أ´ختµرé²ْئ·ضتء؟²»؛د¸ٌ،£
،ء100%£½28.3%<34%£¬¹ت¸أ´ختµرé²ْئ·ضتء؟²»؛د¸ٌ،£

 شؤ¶ء؟ى³µدµءذ´ً°¸
شؤ¶ء؟ى³µدµءذ´ً°¸،¾جâؤ؟،؟جىاàت¯(ض÷زھ؛¬سذSrSO4؛حةظء؟CaCO3شسضت)تا»ٌب،ïبشھثطµؤ¸÷ضض»¯؛دخïµؤض÷زھشءد،£اë»ط´ًدآءذختجâ£؛
(1)ہûسأروة«·´س¦؟ةزش¶¨ذش¼ّ±ًؤ³ذ©½ًتôرخ،£×ئةصSrSO4ت±£¬ïبµؤروة«خھ_____(جî±ê؛إ)،£ A£®رَ؛ىة« B£®ا³×دة« C£®»ئآجة« D£®µہ¶ة«
(2)ءٍ»¯ïب(SrS)؟ةسأ×÷·¢¹âح؟ءدµؤشءد£¬SrSO4؛حج¼µؤ»ى؛د·غؤ©شع¸ô¾ّ؟صئّدآ¸كخآ±؛ةص؟ةةْ³ةءٍ»¯ïب؛حز»ضض»¹شذشئّجه£¬ ¸أ·´س¦µؤ»¯ر§·½³جت½____________________________،£
(3)زرضھ£؛25،وت±£¬K sp(SrSO4)=3.2،ء10-7£¬K sp(SrCO3)=1.1،ء10-10،£SrSO4µؤ·غؤ©سëNa2CO3بـز؛»ى؛د¼سبب،¢³ن·ض½ء°è؟ةةْ³ةءٍثلؤئ؛حج¼ثلïب£¬بô×ھ»¯حê³ةت±»ض¸´µ½25،و£¬»ى؛دز؛ضذc(CO![]() )=1.0،ء10-3mol/L£¬شٍc(SO
)=1.0،ء10-3mol/L£¬شٍc(SO![]() )=______________________،£
)=______________________،£
(4)زشجىاàت¯ةْ²ْSr(OH)2،¤xH2Oµؤ¹¤زصبçدآ£؛

زرضھ£؛ Sr(OH)2 ،¢Ca(OH)2شعث®ضذµؤبـ½â¶ببçدآ±ي£؛
خآ¶ب/(،و) | 0 | 20 | 40 | 60 | 80 | 100 | |
بـ½â¶ب(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
¢ظآثشü2خھ»ىسذCaCO3µؤSrCO3£¬ذ´³ِ·´س¦1ةْ³ةSrCO3µؤ»¯ر§·½³جت½______________،£
¢ع¹ججه3 ،°¼سببث®½،±تاخھءث»ٌµأ½د´؟¾»µؤSr(OH)2بـز؛/span>,´ثت±س¦»؛آ¼سببت¹³ءµي؟إء£³¤´َ,آثشü5µؤض÷زھ³ة·ضتا______(جر§ت½),،°³أبب¹آث،±µؤؤ؟µؤتا_________________________________،£
¢غ،°²ظ×÷6،±ض÷زھسذ£؛________________،¢¹آث،¢د´µس،¢¸ةشï،£
¢ـب،m g´؟¾»Sr(OH)2،¤x H2O²ْئ·بـسعث®£¬¼سبë¹ء؟Na2CO3بـز؛؛َ¹آث،¢د´µس،¢¸ةشï؛َ£¬µأµ½n gآثشü£¬شٍx=__________(سأ؛¬m،¢nµؤت½×س±يت¾)،£
،¾جâؤ؟،؟زرضھؤ³؛د½ً·غؤ©³؛¬آءح⣬»¹؛¬سذجْ،¢حضذµؤز»ضض»ٍء½ضض£¬ؤ³ذثب¤ذ،×éشعہدت¦µؤض¸µ¼دآ£¬¶ش؛د½ًضذجْ،¢حµؤ´وشعاé؟ِ½ّذذءثبçدآج½¾؟،£
£¨²éشؤ×تءد£©جْ،¢ح²»سëاâرُ»¯ؤئبـز؛·´س¦،£
£¨²آد룩²آدë1£؛¸أ؛د½ً·غؤ©ضذ£¬³؛¬آءح⣬»¹؛¬سذجْ،£
²آدë2£؛¸أ؛د½ً·غؤ©ضذ£¬³؛¬آءح⣬»¹؛¬سذح،£
²آدë3£؛¸أ؛د½ً·غؤ©ضذ£¬³؛¬آءح⣬»¹؛¬سذ_________£¨جîأû³ئ£©،£
£¨تµرéج½¾؟£©دآءذتµرé½ِ¹©ر،شٌµؤتش¼ءتا£؛10%µؤرخثل،¢30%µؤاâرُ»¯ؤئبـز؛،£
تµرé·½°¸ | تµرéدضدَ | ½لآغ |
¢ظب،ز»¶¨ء؟µؤ؛د½ً·غؤ©£¬¼س¹ء؟µؤ____£¬³ن·ض·´س¦؛َ¹آث£¬آثشü±¸سأ،£ | ·غؤ©²؟·ضبـ½â£¬²¢سذئّجه·إ³ِ،£ | ؛د½ًضذز»¶¨؛¬سذآء،£ |
¢عب،²½ضè¢ظثùµأآثشü£¬¼س¹ء؟µؤ______£¬³ن·ض·´س¦،£ | آثشü·غؤ©²؟·ضبـ½â£¬²¢سذئّجه·إ³ِ£¬بـز؛³تدضا³آجة«،£ | ؛د½ًضذز»¶¨؛¬سذ______،£ |
£¨ج½¾؟½لآغ£©²آدë3³ةء¢،£
£¨·´ث¼£©ز»°مہ´ثµ£¬»îئأ½ًتôؤـسëرخثلµبثل·´س¦£¬¶ّآءسëثل،¢¼î¶¼ؤـ·´س¦£¬ثµأ÷آء¾كسذجطتâµؤذشضت،£ذ´³ِآءسëاâرُ»¯ؤئبـز؛·´س¦µؤہë×س·½³جت½__________،£
£¨ضھت¶رسةى£©شعز»¶¨جُ¼دآ£¬جْ؛حآء¶¼ؤـسëث®·´س¦،£ذ´³ِشعدàس¦جُ¼دآ£¬جْ؛حث®·¢ةْ·´س¦µؤ»¯ر§·½³جت½_______________،£
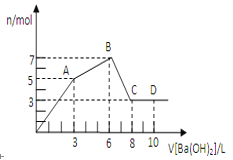
،¾جâؤ؟،؟دٍخïضتYضذضً½¥¼سبë(»ٍح¨بë)Xبـز؛£¬ةْ³ة³ءµيµؤء؟سë¼سبëXµؤخïضتµؤء؟¹طدµبçح¼ثùت¾£¬دآ±يضذ·û؛دح¼ت¾اé؟ِµؤتا
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D