题目内容
9.以下叙述中错误的是( )| A. | 钠和氯气反应生成食盐后,其结构的稳定性增强 | |
| B. | 离子化合物不一定都易溶于水 | |
| C. | 任何离子键在形成的过程中必定有电子的得与失 | |
| D. | 钠和氧气反应生成过氧化钠后,体系的能量降低 |
分析 A.NaCl中离子满足最外层8电子稳定结构;
B.AgCl、硫酸钡等离子化合物不溶于水;
C.离子键的形成只是阴、阳离子间的静电作用,并不一定发生电子的得失;
D.为放热反应,生成稳定的化合物.
解答 解:A.NaCl中离子满足最外层8电子稳定结构,则钠和氯气反应生成食盐后,其结构的稳定性增强,故A正确;
B.AgCl、硫酸钡等离子化合物不溶于水,而离子化合物NaCl易溶于水,则离子化合物不一定都易溶于水,故B正确;
C.离子键的形成只是阴、阳离子间的静电作用,并不一定发生电子的得失,如Na+与OH-结合成NaOH,故C错误;
D.生成稳定的化合物,且该反应为放热反应,则体系的能量降低,故D正确;
故选C.
点评 本题考查离子化合物的结构与特征,为高频考点,把握离子化合物的形成及反应中能量变化为解答的关键,选项C为解答的易错点,题目难度中等.

练习册系列答案
相关题目
20.下列实验中,所选试剂与装置均合理的是( )

| A. | 用饱和食盐水除去氯气中的氯化氢,选① | |
| B. | 分离溶液和胶体,选② | |
| C. | 用自来水制取蒸馏水,选③ | |
| D. | 用酒精提取碘水中的碘,选④ |
17.关于氢键,下列说法正确的是( )
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| C. | 由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大 | |
| D. | H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致 |
4.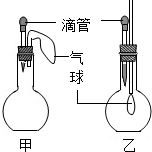 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:NaOH溶液和CO2 | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气 |
13.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
| A. | Zn+Ag2O+H2O═Zn(OH)2+2Ag | B. | Pb+PbO2+2H2SO4═2PbSO4+2H2O | ||
| C. | Zn+CuSO4═Cu+ZnSO4 | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |
14.15g物质A和10.5g物质B完全反应,生成7.2g物质C、1.8g物质D和标准状况下6.72L的气态物质E,则物质E的摩尔质量是( )
| A. | 16.5 g/mol | B. | 85 g/mol | C. | 55 g/mol | D. | 27.5 g/mol |
 石灰氰,是由氰氨化钙(CaCN2)、氧化钙和其他不溶性杂质构成的混合物.呈灰黑色,有特殊臭味.是一种碱性肥料,也是高效低毒多菌灵农药的主要原料之一,可用作除草剂、杀菌剂、杀虫剂等,可用于生产双氰胺、三聚氰胺和氰熔体等.
石灰氰,是由氰氨化钙(CaCN2)、氧化钙和其他不溶性杂质构成的混合物.呈灰黑色,有特殊臭味.是一种碱性肥料,也是高效低毒多菌灵农药的主要原料之一,可用作除草剂、杀菌剂、杀虫剂等,可用于生产双氰胺、三聚氰胺和氰熔体等.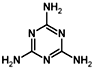 )俗称“蛋白精”,也可由氰氨化钙制得.在三聚氰胺分子中含有的σ键和π键数目之比为5:1.
)俗称“蛋白精”,也可由氰氨化钙制得.在三聚氰胺分子中含有的σ键和π键数目之比为5:1.