题目内容
14.将等物质的量A,B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)?xC(g)+2(g),经反应5min后.测D的浓度为0.5mol/L,A,B的物质的量浓度之比为3:5,C的平均反应速率是0.1mol/(L•min ),则x的值为( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 经5min后,测得D的浓度为0.5mol•L-1,v(D)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),C的平均反应速率是0.1mol/(L•min),速率之间等于化学计量数之比.
解答 解:经5min后,测得D的浓度为0.5mol•L-1,v(D)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),C的平均反应速率是0.1mol/(L•min),由速率之间等于化学计量数之比可知,$\frac{v(D)}{v(C)}$=$\frac{2}{x}$,解得x=2.
故选B.
点评 本题考查化学反应的有关计算,为高频考点,把握化学反应速率及化学平衡的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
相关题目
5.电子计算器中所用的纽扣电池为银锌电池,其电极分别为Ag2O 和Zn,电解质溶液为KOH溶液.电极反应式为:Zn+2OH--2e-═Zn(OH)2、Ag2O+H2O+2e-═2Ag+2OH-下列叙述中,正确的是( )
| A. | 电流由锌经外电路流向氧化银 | |
| B. | 锌是负极,氧化银是正极 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
2.从下列叙述中,可以肯定金属A比金属B的活泼性强的是( )
| A. | A,B用导线连接后浸入电解质溶液,结果电子从B流向A | |
| B. | A从酸中置换出H2比B从酸中置换H2难 | |
| C. | 1 mol A从酸中置换出H十生成的H2比1mol B从酸中置换出H十生成的H2多 | |
| D. | 常温时,A能从水中置换出氢气,而B不能 |
9.以下叙述中错误的是( )
| A. | 钠和氯气反应生成食盐后,其结构的稳定性增强 | |
| B. | 离子化合物不一定都易溶于水 | |
| C. | 任何离子键在形成的过程中必定有电子的得与失 | |
| D. | 钠和氧气反应生成过氧化钠后,体系的能量降低 |
19.下列对乙烯分子的叙述中错误的是( )
| A. | 乙烯分子里所有的原子在同一平面上 | |
| B. | 乙烯的结构简式为CH2CH2,电子式为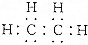 | |
| C. | 乙烯分子中碳氢键之间的夹角约为120° | |
| D. | 乙烯分子中既含有极性键又含有非极性键 |
19.下列离子方程式错误的是( )
| A. | 硫酸与氢氧化钡反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2 H2O | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | CO2通入过量的澄清石灰水中 CO2+Ca2++2OH-=CaCO3↓+H2O | |
| D. | 钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu |

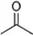 根据键线式回答下列问题:
根据键线式回答下列问题: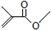 分子式:C5H8O2,
分子式:C5H8O2,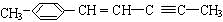 分子中最多有4个原子共直线;
分子中最多有4个原子共直线;
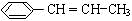 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
.