题目内容
17.关于氢键,下列说法正确的是( )| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| C. | 由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大 | |
| D. | H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致 |
分析 A.氢键存在于分子间,化学键存在于分子内;
B.氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点;
C.电负性大的元素的氢化物中易形成氢键;
D.氢键只影响物质的物理性质,与化合物的稳定性无关.
解答 解:A.氢键存在于分子间,化学键存在于分子内,所以氢键不是化学键,故A错误;
B.氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点,故B正确;
C.电负性大的元素的氢化物中易形成氢键,故C错误;
D.氢键只影响物质的物理性质,H2O是一种非常稳定的化合物,是因为H-O键的稳定性强,故D错误.
故选:B.
点评 本题考查了氢键的存在和对物质性质的影响,题目难度不大,把握氢键的概念是解题的关键,注意氢键只影响物质的物理性质,与物质的稳定性无关.

练习册系列答案
相关题目
8.某无色水溶液中能大量共存的离子组是( )
| A. | K+、Na+、CO32-、Cl- | B. | Ca2+、K+、CO32-、OH- | ||
| C. | Fe3+、Ba2+、NO3-、SO4- | D. | H+、Na+、HCO3-、OH- |
5.电子计算器中所用的纽扣电池为银锌电池,其电极分别为Ag2O 和Zn,电解质溶液为KOH溶液.电极反应式为:Zn+2OH--2e-═Zn(OH)2、Ag2O+H2O+2e-═2Ag+2OH-下列叙述中,正确的是( )
| A. | 电流由锌经外电路流向氧化银 | |
| B. | 锌是负极,氧化银是正极 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
2.从下列叙述中,可以肯定金属A比金属B的活泼性强的是( )
| A. | A,B用导线连接后浸入电解质溶液,结果电子从B流向A | |
| B. | A从酸中置换出H2比B从酸中置换H2难 | |
| C. | 1 mol A从酸中置换出H十生成的H2比1mol B从酸中置换出H十生成的H2多 | |
| D. | 常温时,A能从水中置换出氢气,而B不能 |
9.以下叙述中错误的是( )
| A. | 钠和氯气反应生成食盐后,其结构的稳定性增强 | |
| B. | 离子化合物不一定都易溶于水 | |
| C. | 任何离子键在形成的过程中必定有电子的得与失 | |
| D. | 钠和氧气反应生成过氧化钠后,体系的能量降低 |
2.乙烯的产量是衡量一个国家石油化工生产水平的标志,这是由于乙烯在石油化工生产中具有广泛的用途.下列关于乙烯的用途叙述不正确的是( )
| A. | 以乙烯为原料可以合成聚乙烯等制备生活用品的材料 | |
| B. | 乙烯可以用来制备1,2-二氯乙烷(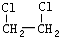 ) ) | |
| C. | 乙烯可以与水发生加成反应制备乙醇(CH3CH2OH) | |
| D. | 乙烯可以与Br2发生加成反应制备二溴乙烷(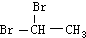 ) ) |
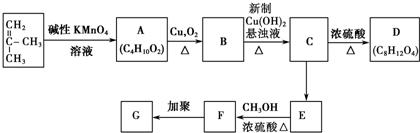
 ,G的结构简式是
,G的结构简式是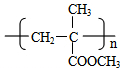 .
.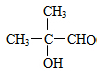 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$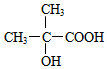 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.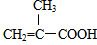 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O. 根据键线式回答下列问题:
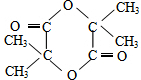
根据键线式回答下列问题: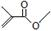 分子式:C5H8O2,
分子式:C5H8O2, 分子中最多有4个原子共直线;
分子中最多有4个原子共直线;
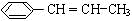 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
.