题目内容
1.已知:C2H4(g)+H2O(g)═C2H5OH(g),△H=-45.5kJ•mol-1,乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产.如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2OnH2O:nC2H4nC2H4=1:1).(1)列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=0.07(MPa)-1;(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
(2)图中压强(p1、p2、p3、p4)的大小顺序为p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高.

分析 (1)Kp=P(C2H5OH)P(C2H4)×P(H2O),设C2H4、H2O的起始物质的量分别为1mol,利用三段法计算平衡各组分物质的量,进而计算分压带入表达式计算;
(2)在相同温度下由于乙烯转化率为p1<p2<p3<p4,正反应为气体体积减小的反应,增大压强平衡向正反应分析移动,乙烯的转化率增大.
解答 解:(1)设C2H4、H2O的起始物质的量分别为1mol,A点乙烯转化率为20%,故参加反应的乙烯为0.2mol,则:
C2H4(g)+H2O(g)═C2H5OH(g)
开始(mol):1 1 0
转化(mol):0.2 0.2 0.2
平衡(mol):0.8 0.8 0.2
乙醇占0.20.8+0.8+0.2=19,乙烯和水各占0.80.8+0.8+0.2=49,则乙醇的分压为7.85MPa×19=0.87MPa,乙烯和水的分压为7.85MPa×49=3.49MPa,
所以Kp=P(C2H5OH)P(C2H4)×P(H2O)=0.87MPa3.49MPa×3.49MPa=0.07(MPa)-1,
故答案为:0.07(MPa)-1;
(2)由图可知,在相同温度下乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)△H=-45.5kJ•mol-1,可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4,
故答案为:p1<p2<p3<p4;反应分子数减少,相同温度下,压强升高乙烯转化率提高.
点评 本题考查化学平衡常数计算、化学平衡图象及影响因素,属于中等难度,有利于学生分析解决问题、知识迁移能力的培养.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 能使pH试纸呈红色的溶液:CH3COOH、NH4+、I-、NO3- | |
| B. | pH=14的溶液:Ba2+、Mg2+、HCO3- | |
| C. | c(Fe3+)=0.1mol/L的溶液:H+、Al3+、Cl-、SCN- | |
| D. | kw/c(H+)=0.1mol/L的溶液:Na+、NH3•H2O、SiO32-、NO3- |
| A. | 钠和氯气反应生成食盐后,其结构的稳定性增强 | |
| B. | 离子化合物不一定都易溶于水 | |
| C. | 任何离子键在形成的过程中必定有电子的得与失 | |
| D. | 钠和氧气反应生成过氧化钠后,体系的能量降低 |
| A. | 加热碘,收集到紫黑色固体 | |
| B. | 将NaCl固体溶于水后离子键被破坏 | |
| C. | 将CCl4加入溴水中,观察到CCl4成橙色 | |
| D. | 将H2O2滴加在MnO2中,可收集到无色气体 |
| A. | 无水CaCl2 | B. | 浓H2SO4 | C. | P2O5 | D. | 碱石灰 |
| A. | 硝基苯中混有NO2,加稀NaOH溶液反复洗涤、分液 | |
| B. | 乙烷中混有乙烯,将其通入溴水中洗气 | |
| C. | 获得无水乙醇的方法通常采用先用浓硫酸吸水,然后再加热蒸馏的方法 | |
| D. | 乙酸乙酯中混有乙酸,加饱和碳酸钠溶液反复洗涤、分液 |
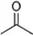 根据键线式回答下列问题:
根据键线式回答下列问题: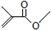 分子式:C5H8O2,
分子式:C5H8O2,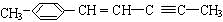 分子中最多有4个原子共直线;
分子中最多有4个原子共直线;
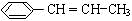 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: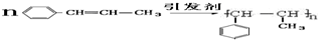 .
.